
20.(8分)有一无色透明溶液,欲确定含有下列离子中的哪几种:
K+、Mg2+、Al3+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-。取该溶液实验如下:
|
实验步骤 |
实现现象 |
|
(1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
|
(2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,气体遇空气变成红棕色 |
|
(3)取少量该溶液,加足量BaCl2溶液 |
有白色沉淀生成 |
|
(4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于HNO3 |
|
(5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是 ,溶液中肯定不存在的离子是 。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称:
19.(10分)有X、Y、Z三种常见元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学方程式 ;
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式:
此液体具有的性质是 (填写序号字母)。
a. 光束通过该液体时形成光亮的“通路”
b. 插入电极通过直流电后,阴极附近液体颜色加深
c. 向该液体中加入硝酸银溶液,无沉淀产生
d. 将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体R。已知一定条件下,每1mol气体R被O2完全氧化生成气体L放热98.0KJ。
①写出R被氧化的热化学方程式:
②若2mol R与1mol O2在此条件下发生反应,达到平衡时放出的热量是188.2kJ,则R的转化率为 。(保留三位有效数字)
18.(12分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意如
图1所示。
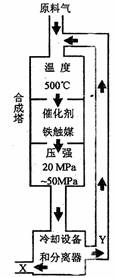
图1
①X分子的空间结构为 ;
②图1中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
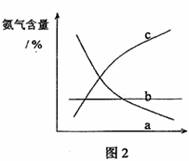
③改变反应条件,会使平衡发生移动。如图2表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
;
②常温时,氨水中由水电离出的c(H+)·c(OH-) 10-14(填写“>”、“<”或“=”);
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3mol A。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1mol B,转移电子的物质的量为 mol。
17.(8分)甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,细(虚)线不表示化学键或分子间作用力,X与Y可以相同也可以不同。已知甲、乙是同 类晶体中的各自结构单元,单质甲能与乙发生置换反应,丙、丁、戊三种粒子含有等量的电子数,其中丙与丁晶体类型相同,常温下化合物丁呈液态,戊是阳离子。
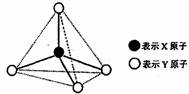
(1)丁的电子式是 ,丁固态时的晶体类型为 。
(2)常温下戊的硝酸盐溶液的pH 。
A.>7 B.=7 C.<7 D.以上都有可能
(3)甲与乙发生置换反应的化学方程式为 。
(4)丙分子的结构式是 ,它是目前重要的能源物质,现代高能电池中常用丙作燃料电池的原料,在碱性介质(KOH溶液)情况下,其负极反应的电极方程式为 。
16.在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较不正确的是 ( )
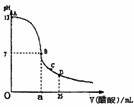
A.在A、B间任一点(不包含A、B两点),溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有:c(Na+)=c(CH3COO-)>c(OH-)=(H+)
C.在C点:c(CH3COO-)> c(Na+)>(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2 c(Na+)
|
15.能正确表示下列反应的离子方程式是 ( )
A.醋酸钠的水解的反应:CH3COO-+H3O+=CH3COOH+H2O
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液中通少量二氧化碳C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
13.对下列各种溶液中所含离子的判断合理的是 ( )
A.向无色溶液中加氯水变橙色,溶液中可能含:Cl-、Br-、H+、Cu2+
B.在常温下加入铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
C.常温,在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO2-,CO32-,SO32-
D.使紫色石蕊试液变蓝色的溶液中可能含:K+,Na+,Ca2+,CO32-
|
|
C3N3(OH)3 3HNO3; 8HNCO+6NO2 7N2+8CO2+4H2O
下列说法正确的是 ( )
A.C3N3(OH)3与HNCO互为同分异构体
B.HNCO是一种很强的氧化剂
C.1mol NO2在反应中转移的电子为4mol
D.反应中NO2是还原剂
12.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是 ( )
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:Ni2+-e-=Ni3+
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子
11.某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为 ( )
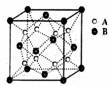
A.B2A B.BA2 C.B7A4 D.B4A7
10.已知:CH3CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);△H=-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)→4 CO2(g)+5H2O(l);△H=-2869kJ/mol
|
A.正丁烷的燃烧热为2878kJ
B.正丁烷分子储存的能量大于异丁烷分子
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com