
29.(5分)已知Cl2、Al2(SO4)3、CaC2、C2H5Br、CH3COCH3等物质均能与水反应,反应中各物质和水分别解离成两部分,然后两两重新组合形成新的物质。今有下列五种物质,常温下很容易与水发生反应:
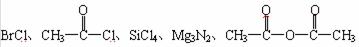
试问:
(1)在后面所给出的五种物质与水反应的产物中,属于最高价氧化物的水化物的是
属于无氧酸的是 。
(2)分别将0.01 mol的这五种物质放入0.1 L水中反应,结果使溶液的pH值接近3的原物质是 。
28.(5分) 1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
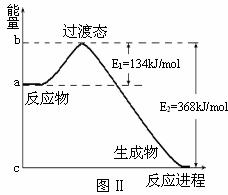
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/ kJ·mol–1 |
197 |
360 |
499 |
X |
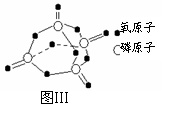

已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X= 。
27.(3分)将等体积的0.4 mol/L CH3COONa溶液与0.2 mol/L HNO3溶液相混合,混合液中各离子浓度按由大到小的顺序排列为_______________________________。
26.(7分)
(1)某学生中和滴定实验的过程如下:a. 取一支碱式滴定管,b. 用蒸馏水洗净,c. 即加入待测的氢氧化钠溶液,d. 记录液面刻度读数,e. 用酸式滴定管精确放出一定量标准溶液,f. 置于未经标准酸液润洗过的洁净锥形瓶,g. 加入适量蒸馏水,h. 加入酚酞2滴,i. 滴定时,边滴边摇荡,j. 边注视滴定管内液面刻度读数,k. 当小心滴到溶液由无色变为粉红色时,即停止滴定,l. 记录液面刻度读数,m. 根据滴定管的两次读数得出NaOH溶液的体积为22 mL。
指出实验过程中的错误之处(用编号表示): (注:错一处,倒扣一分,但本小题不出现负分。)
(2)下图为常见仪器的部分结构(有的仪器被放大)
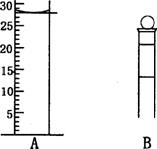
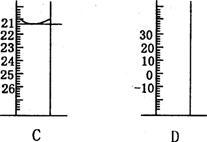
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
25.(8分)
(1)将等体积等物质的量浓度的盐酸和氨水混合后,呈_____性,溶液中C(NH4+)与C(Cl-)的大小关系是___________________;
(2)将PH=3的盐酸和PH=11的氨水等体积混合后溶液呈_____性,溶液中C(NH4+)与C(Cl-)的大小关系是___________________;
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中C(NH4+)与C(Cl-)浓度相等,则混合溶液呈_____性,盐酸与氨水体积大小关系是_________________;
(4)将m mol· L-1的盐酸和n mol·L-1氨水等体积混合后,溶液的PH=7,m与n的大小关系是____,则盐酸中C(H+)与氨水中C(OH-)的大小关系是_______;
24.(7分) A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生产盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素离子的结构示意图是 。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是 。(填化学式),B的10电子氢化物的分子空间构型为 。
(3)B与E可形成离子化合物BE5、BE5的电子式是 ,含有的化学键类型有 。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物结构是 (填字母标号a或b)

23.(9分) 某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氧化铅,其中Pb为+2价,N平均为-1/3价)六种物质,已知Pb(N3)2是反应物之一。根据你学过的有关化学定律和知识,回答下列问题:
(1)铅(Pb)的常见化合价是 ,将Pb3O4写成常见化合价的氧化物的形式为 __ (已知Fe3O4可写成FeO·Fe2O3)。
(2)已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 ,Mn的化合价为 。
(3)Pb(N3)2在该反应中是 剂,它的产物是 ,1mol Pb(N3)2参加反应,转移电子数是 mol。
22.下列装置中属于原电池的是( ) 属于电解池的是 ( )
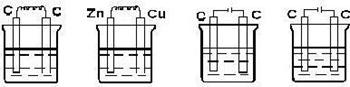
A B C D
稀硫酸 稀硫酸 稀硫酸 二硫化碳
|
21.常温下,用1.0 mol·L-1 NaOH 溶液中和某浓度硫酸溶液时,其pH和所加NaOH 溶液的体积关系如下图所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是: ( )
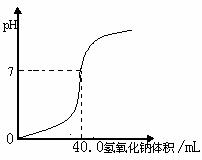
A.1.0 mol·L-1,60mL
B.0.5 mol·L-1,80mL
C.0.5mol·L-1,40mL
D.1.0 mol·L-1,80mL
20.4体积的pH=9的Ca(OH)2溶液与1体积的pH=13的NaOH溶液混合后,溶液中氢离子浓度为 ( )
A.5×10-13mol/L B.2×10-12mol/L
C.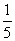 (l×10-1+4×10-5)mol/L D.
(l×10-1+4×10-5)mol/L D.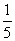 (l×10-13+4×10-9)mol/L
(l×10-13+4×10-9)mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com