
11. 一定温度下可逆反应:A(s)+2B(g)
2C(g);△H<0。现将1molA和2molB加入甲溶液中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的溶积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是 ( )
一定温度下可逆反应:A(s)+2B(g)
2C(g);△H<0。现将1molA和2molB加入甲溶液中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的溶积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是 ( )
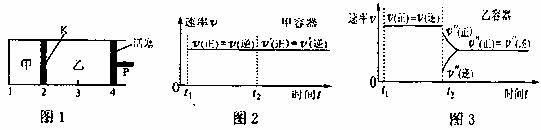
A.保持温度和活塞位置不变,在甲中加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍。
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍。
D.保持温度的乙中的压强不变,t2时分别向甲、乙中加入等量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
9.下列叙述正确的是 ( )
A.分子晶体中的每一个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
|
A.0.1mol·L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.1 mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1mol·L-1NaHCO3溶液中:
c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
8.将V1mL 1.0mol/L HC1溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度, 实验结果如图所示(实验中始终保持 V1+V2=50mL)。下列叙述正确的是( )
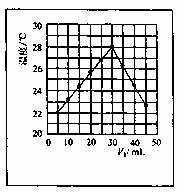
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00mL/L
D.该实验表明有水生成的反应都是放热反应
7.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数3倍或者是Y原子最外层电子数的3倍。下列说法正确的是 ( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
6.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
 2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件。SO2气体平衡浓度不改变的是 ( )
2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件。SO2气体平衡浓度不改变的是 ( )
A.保持温度和容器体积不变,充入1molSO3(g)
B.保持温度和容器内压强不变,充入1molSO3(g)
C.保持温度和容器内压强不变,充入1molO2(g)
D.保持温度和容器内压强不变,充入1molAr(g)
5.下列叙述正确的是 ( )
A.48g O3气体含有6.02×1023个O3分子
B.常温常压下,4.6g NO2气体含有1.81×1023个NO2分子
C.0.5mol·L-1CuC12溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
4.下列离子方程式书写正确的是 ( )
A.过量的SO2通过NaOH溶液中:SO2+2OH-=SO32-+H2O
B.Fe(NO3)2溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
3.下列关于元素周期表和元素周期定律的说法错误的是 ( )
A.Li、Na、K元开素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
2.秘(Bi)在医药方面有重要应用。下列关于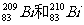 的说法正确的是 ( )
的说法正确的是 ( )
A.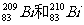 都含有83个中子 B.
都含有83个中子 B.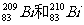 互为同位素
互为同位素
C.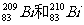 的核外电子数不同 D.
的核外电子数不同 D.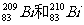 分别含有126和127个质子
分别含有126和127个质子
1.下列说法正确的是 ( )
A.可用丁达尔现象区分溶液与胶体 B.生石灰与水混合的过程只发生物理变化
C.O2是由3个氧原了构成的化合物 D.CuSO4·5H2O是一种混合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com