
21.(12分)为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
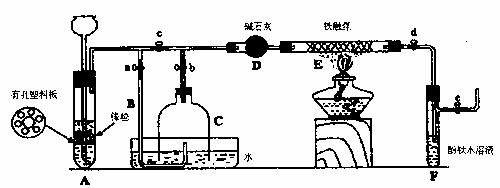
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
20.(8分)“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t1= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进么编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22.0s B.22.0s-44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
19.(15分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是 、B元素是 、C元素是 (用元素符号表示)
(2)D是由两种元素组在的双原子分子,其分子式是 。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 、
(4)F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
(5)G分子中含有4个原子,其分子式是
。
(6)H分子中有8个原子,其分子式是
。
18.向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O(g) CO2+H2。
当反应达到平衡时,CO的体积分数为x。若维持容寄器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1 mol CO+1molH2O(g)+1 mol CO2+1 mol H2
C.0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4 molH2
D.0.5mol CO+1.5mol H2(g)+0.5mol CO2+0.5mol H2
|
17.在25℃时,将pH=11的NaOH溶液与 pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是 ( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
 D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
16.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:
 2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(L·s)
B.将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
15.X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y2可能是离子化合物,也可能是共价化合物
14.在由水电离产生的H+浓度为1×10-13mol/L的溶液中,一定能大量区存的离子组是( )
①K+、C1-、NO3-、S2- ②K+、Fe2+、I-、SO42-
③Na+、C1-、NO3-、SO42- ④Na+、Ca2+、C1-、HCO3-
⑤K+、Ba2+、C1-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
13.下列关于盐酸与醋酸两种稀溶液的说法正确的是 ( )
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量的对应的钠盐,c(H+)均明显减小
12.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是 ( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com