
21.(5分)有A、B、C、D、E、F、G七种气体,它们分别是CO、O2、H2、CO2、HBr、HCl中一种,现有如下实验事实:
①A、B、C均难溶于水,D、E能溶于不,F、G易溶于水;
②A和C都能燃烧,A在空气中燃烧的产生与Na2O2反应生成B,C在E中燃烧的火焰为苍白色,生成物是F;
③将适量E通入G的水溶液中,溶液变为棕黄色
(1)试判断A、C、F各是什么气体:
A ,C ,F 。(均填物质的化学式)
(2)写出E通入G的水溶液中的离子方程式: 。
20.(16分)“化学多米诺实验”是利用反应气体产生压力和虹吸作用原理,使若干化学验
依次发生,整个过程只需要控制第一个反应,就好像多米诺骨牌一样。下面就一个“化学多米诺实验”。各装置中试剂或者物质为:
A – 2mol/ LH2SO4; B – Zn; C – 2mol/ LH2SO4 + CuSO4;D-Zn
E – CuSO4;F– NH3·H2O;G – 30% H2O2; H – H2S溶液; I – NaOH溶液
已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,该反应的产物可作H2O2分解的催化剂。
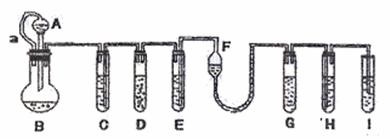
请回答下列问题:
(1)“化学多米诺实验”成功的关键之一是控制好第一反应,之二是 。
(2)B与D两容器中反应的速率比较B D(填>,<,=),原因是
。
(3)H中的现象是 。
(4)I的作用是(用离子方程式表示) 。
(5)A和B之间的导管a的作用是 。
(6)在该实验中涉及的反应类型是(填序号) 。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
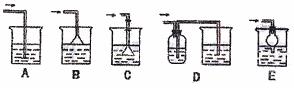
(7)如果从H中导出的气体是极易溶于水的气体,下列哪个装置能代表I?请序号 。
19.(6分)一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2F3++Cu === 2Fe2+ + Cu2+的拆写结果为:氧化反应式为Cu-2e- === Cu2+;还原反应为2F3+ + 2e-===Cu2+。
(1)据以上信息将反应3NO2 + H2O === 2H+ + 2NO3-+NO拆写两个“半反应式”。氧化反应式为 ;还原反应式为 。
(2)已知某一反应的半反应式为CH4+10OH--8e-===4OH-,O2+2H2O+4e-=4OH-则总反应方程式为 。
|
18.某稀溶液中所含有Fe(NO3)2、Cu(NO3)2、HNO3,向其中逐渐中入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
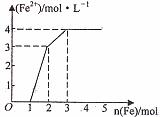
A.1:1:1 B.1:3:1
C.3:3:8 D.1:1:4
17.雅典奥运会上使用的发令枪,所用火药的成分是氯酸钾和红磷,经撞击发出响声并同时产生白色烟雾,此时发生的反应如下:5KclO3 + 6P === 3P2O5 + 5KCl,则下列有关叙述错误的是 ( )
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.产生白色烟雾的原因是生成的五氧化二磷为白色小颗粒(烟)吸水性很强,吸收空气中的水分,部分生成磷酸小液滴(雾)
C.上述反应中消耗3molP时,转移15mol电子
D.因红磷和白磷互为同素异形体,所以在此火药中可以用白磷代替红磷
16.将50g溶质质量分数为ω1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到VmL水中,稀释后得到溶质质量分数为ω2,物质的量浓度为c2的稀硫酸。若c1=2c2则 ( )
A.ω1 >2ω2,V > 50 B.ω1 <2ω2,V < 50
C.ω1 =2ω2,V > 50 D.ω1 <2ω2,V > 50
15.有A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍,由这三种元素组成的化合物的化学式不可能是 ( )
A.A2(BC4)3 B.A3BC4 C.A2BC3 D.A2BC4
14.已知H2O(l) === H2O(g);△H = +Q1kJ/mol
2H2O(g) === 2H2(g) + O2(g);△H = +Q2kJ/mol
CH4(g) + 2O2(g) === CO2(g) + 2H2O(l);△H =-Q3kJ/mol
则H2和CH4的燃烧热之比是 ( )
A.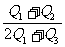 B.
B.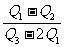
C.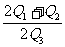 D.
D.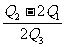
13.下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是 ( )
A.Ba(OH)2 KSCN NaCl Mg(NO3)2 (FeCl3溶液)
B.NaNO3 NaHCO3 (NH4)2SO4 NaSiO3 (H2SO4溶液)
C.NH4Br K2CO3 NaI CaCl2(AgNO3溶液)
D.(NH4)3PO4 NaBr CuSO4 AlCl3(KOH溶液)
12.比较锌和二氧化锰分别与盐酸的反应,下列叙述错误的是 ( )
A.盐酸都是被还原
B.两个都是氧化还原反应
C.若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化
D.等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com