
26.(10分)在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(气)+H2O(气) CO2(气)+H2(气)(正反应是放热反应)
CO2(气)+H2(气)(正反应是放热反应)
(1)改变条件,能使正反应速率增大的是 (填序号)
A.降温 B.加压 C.增大CO2的浓度 D.使用催化剂
(2)CO和H2O浓度变化如下图,则0-4min的平均反应速率v (CO)= mol/(L·min)
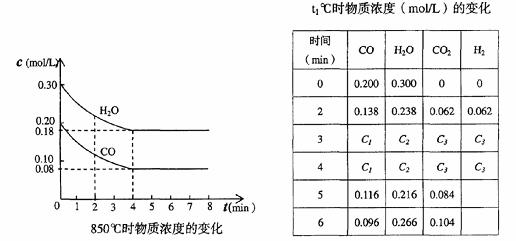
(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min间,平衡向逆方向移动,可能的原因是________,表中5min-6min之间数值发生变化,可能的原因是__________。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
25.(6分)(1)将位于同一周期的主族元素A和B的氯化物AClX和BClY配制成等物质的量浓度的溶液,测得AClX溶液的pH小于BClY溶液的pH。试判断A、B两元素原子序数的大小关系_________
(2)pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后,溶液呈酸性。
①反应所生成的正盐的化学式为__________
②该盐中________离子一定水解,水解的离子方程式为__________
24.(6分)关于下列两个反应:
①0.1mol/L醋酸溶液:CH3COOH CH3COO-+H+
CH3COO-+H+
②0.1mol/L醋酸钠溶液:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
(1)两式到达平衡后,加入一定量的水后,平衡向右移动的是_______,溶液的pH增大的是______(此问填序号)。
(2)向②反应中加入少量的醋酸钠固体,溶液的pH将________(填增大、减小、不变),若加入少量的CH3COOH,使溶液中c(Na+)=c(CH3COO-)则溶液的pH为_______(填数值)。
(3)若向①反应中加入少量的冰醋酸,溶液的pH将_______,电离程度将____ (填增大、减小、不变)
23.(6分)已知某溶液中只含有OH-、H+、NH4+、Cl- 四种离子。
(1)若溶液中只溶解了一种溶质,则该溶质是_______________________。
(2)若溶液中c (NH4+)>c (Cl-)>c (OH-)>c (H+),则含有的溶质是__________________。
(3)若溶液是由体积相等的盐酸和氨水混合而成,且恰好呈中性,则混合前c H3·H2O)_________c (HCl)(填“<”、“>”或“=”)。
22.常温下,0.1mol/L的一元酸HA溶液其pH>1,而0.1mol/L的一元碱BOH的溶液中c(OH-)/c(H+)=1012,将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(OH-)<c(H+)<c(A-)<c(B+)
C.c(H+)<c(OH-)<c(A-)<c(B+) D.c(OH-)=c(H+)> c(B+)=c(A-)
21.常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+) B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V总≥20mL D.V总≤20mL
20.已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.HA-的水解离子方程式为:HA-+H2O H3O++A2-
H3O++A2-
C.在Na2A溶液中一定有:c(OH-)= c(H+)+ c(HA-) +c(H2A)
D.在NaHA溶液中一定有:c(Na+)+ c(H+)=c(HA-)+c(OH-)+2c(A2-)
19.用水稀释0.1mol/L的醋酸溶液,其中随水的增加而最终增大的有
①H+的物质的量 ②c(H+) ③c(OH-) ④ 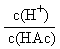 ⑤
⑤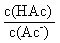
A.①③④ B.①③⑤ C.②④ D.③④
18.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)  2C(g);(正反应放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);(正反应放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
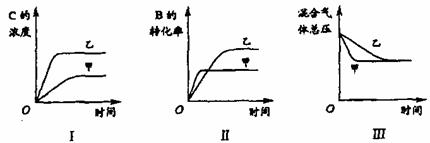
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
17.将8molH2和2molN2充入2L密闭容器中,在一定条件下进行合成氨的反应,4min后反应达到平衡,测得容器中还有5.6molH2。下列计算结果错误的是
A.υ(H2)=0.3mol·L-1·min-1 B.H2的转化率为25%
C.平衡时,NH3的物质的量浓度为0.8mol/L D.反应前后的压强比为25:21
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com