
11.常温下,0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),下列关系中一定正确的是
A.c(Na+)+ c(H+)= c(HB-)+ 2c(B2-)
B.c(H+)·c(OH-)= 10-14
C.c(Na+)= c(B2-)+ c(HB-)
D.溶液的pH=1
10.某氯化镁溶液的密度为1.18g / cm3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl﹣的物质的量约等于
A.0.37 mol B.0.63 mol C.0.74 mol D.1.5 mol
9.某温度下,在一容积可变的密闭容器里,反应2A(g) 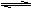 B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
A.充入1mol稀有气体氦(He),平衡将不发生移动
B.充入A、B、C各1mol,平衡将向正反应方向移动
C.将A、B、C各物质的量都减半,C的百分含量不变
D.加入催化剂,正逆反应速率均加快,平衡向逆反应方向移动
8.下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液加水稀释至pH都为5,盐酸加水量多
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
7.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH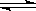 CH3COO-+H+要
CH3COO-+H+要
使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A.加少量烧碱溶液 B.升高温度 C.加少量冰醋酸 D.使用催化剂
6.下列离子方程式书写正确的是
A.铝与烧碱溶液反应:Al+2OH- = AlO2-+H2↑
B.碳酸钙与醋酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O
C.CO2气体通入次氯酸钙溶液中:CO2 + 2ClO- + H2O = CO32- + 2HClO
D.氯化铁溶液呈酸性:Fe3++3H2O  Fe(OH)3 +3H+
Fe(OH)3 +3H+
5.下列各条件下可能共存的离子组是
A.某无色溶液中:NH4+、Na+、Cl-、MnO4-
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、SO32-、CO32-
C.在c(H+)=1×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
4.用NA表示阿伏加德罗常数,下列说法正确的是
A.0.2 mol过氧化氢完全分解转移的电子数目为0.4NA
B.1mol C8H18中含有的共价键为26 NA
C.在常温常压下,17 g硫化氢所含质子数目为8 NA
D.在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA
3.下列事实不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.将FeCl3溶液加热蒸干最终得不到FeCl3固体
C.实验室用排饱和食盐水的方法收集氯气
D.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
2.下列实验方法正确的是
A.用渗析的方法精制氢氧化铁胶体
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.测定溶液pH,用玻璃棒蘸取原溶液点在润湿的pH试纸上立即与比色卡比较
D.测定硫酸铜晶体中结晶水含量,实验过程中至少需要三次称量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com