
24.A为日常调味品之一,K胶体经过处理可用作干燥剂,F为白色腊状固体,B为无色无味液体。请回答下列问题:
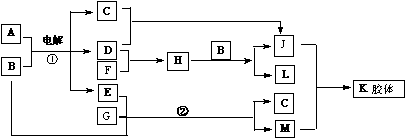
(1)写出下列物质化学式:
A:________; D:________;E:________;
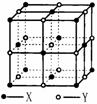
(2)判断晶体A.F、G的熔点高低(用化学式表示)________>_________>______
(3)晶体A由两种微粒构成,其晶体结构如图所示,相邻最近异种微粒间距为a cm,晶体A的密度为ρ g/cm3,则用相关数据表达阿伏加德罗常数NA=__________________。
(4)写出反应②的离子方程式________________。
(5)铁锅与A的溶液接触时容易生锈,可以用方程式表示其原因:
①负极反应:______________正极反应:_______________
②Fe2++2OH-=Fe(OH)2
③__________________________________________________
④ 2Fe(OH)3 + (x-3)H2O==Fe2O3·xH2O(铁锈)
23.X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
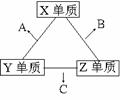
一个B分子中含有的Z原子个数比C分子中少1个。
请回答下列问题:
(1)X元素在周期表中的位置是第 周期 族。
(2)分析同主族元素性质的递变规律,发现B.C物质沸点反常,这是因为它们的分子之间存在 。
(3)①C的电子式是 ,C分子的结构呈 形。
②C在一定条件下反应生成A的化学方程式是 。
③X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式): 。
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
A.达到化学平衡时,正反应速率和逆反应速率相等
B.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
C.达到化学平衡的过程中气体平均相对分子质量减小
D.达到化学平衡后,升高温度,C的体积分数减小
22.某学生欲测定味精中食盐的含量。
(1)下面是该学生所做的有关实验步骤,请填写所缺的实验步骤②和④。
①称取某牌号的袋装味精样品5.0g,并溶于蒸馏水。
② 。
③过滤。
④ 。
⑤将沉淀烘干、称量,测得固体质量为2.9g。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的主要仪器有 。
②检验沉淀是否洗净的方法是 。
③烘干沉淀应采取的方法是
A.低温烘干 B.高温烘干 C.利用太阳能烘干
④若味精包装上标注:“谷氨酸钠含量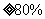 ,
,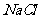 含量
含量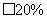 ,”则此样品是否符合产品标示的质量分数
(填“符合”或“不符合”)。
,”则此样品是否符合产品标示的质量分数
(填“符合”或“不符合”)。
21.下图为相互串联的甲、乙两电解池试回答:
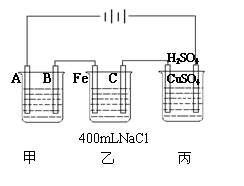

(1)若甲池利用电解原理在铁上镀银,则B是 、 (填电极材料和电极名称), 应选用的电解质溶液是 。
(2)乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色,C极附近呈 色。
(3)若甲槽阴极增重4.32g,乙槽中剩余溶液仍为400mL ,则电解后所得溶液的pH值等于 。
(4)若丙为用石墨电极电解100mLH2SO4和CuSO4混合溶液,通电一段时间后,两极各出现气体2.24L(标准状况),求原来溶液中CuSO4的物质的量浓度为____________。
20.甲酸的下列性质中,可以证明它是弱电解质的是 ( )
A.1mol/L甲酸溶液的pH值约为2
B.甲酸能与水以任何比例互溶
C.10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应
D.在相同条件下,甲酸溶液的导电性比强酸溶液的弱
|
19.分别在等pH或等物质的量浓度的盐酸和醋酸的等体积溶液中,加入足量镁,H+浓度及H2的体积(同温同压下测定)的变化图示如下
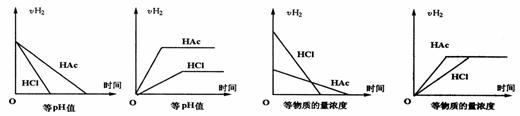
① ② ③ ④
其中正确的是 ( )
A.①③ B.②④ C.①②③ D.①②③④
18.如图a、b、c、d均为铂电极,供选择的四组电解质溶液如下表:
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是 ( )
|
组 |
|
B |
C |
D |
||
|
甲槽 |
NaOH |
AgN O3 |
H2SO4 |
KCl |
||
|
乙槽 |
CuSO4 |
CuCl2 |
AgNO3 |
AgNO3 |

甲 乙
17.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
A.用NaOH和HCl 反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反
应热
B.用沸点数据推测两种液体混合物用分液方法分离开来的可能性
C.用沸点数据来分析分子的稳定性
D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
16.25℃时,体积为VA.pH=a的某一元强酸溶液与体积为VB.pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=6a,Va<Vb。下列有关a的说法正确的是 ( )
A.a可能等于1 B.a一定大于2
C.a一定小于2 D.a一定等于2
15.氢氧燃料电池以为还原剂,为氧化剂,电极为多孔镍,电解质溶液为30%的KOH溶液,以下叙述正确的是 ( )
①放电一段时间后,电解质溶液中KOH的物质的量将改变
②负极反应为:2H2+4OH--4e- = 4H2O
③工作时正极区pH升高,而负极区pH降低
④工作时阴离子移向正极
A.①③④ B.②③ C.②④ D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com