
2.下列物质固态时一定是分子晶体的是 ( )
A.酸性氧化物 B.非金属单质
C.碱性氧化物 D.含氧酸
1.广东北江曾发生严重的水体镉污染事件,专家确定用1200吨的聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)(3-n)/2]m,n<5,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法正确的是 ( )
A.实验室可通过FeSO4溶液水解制聚合铁PFS
B.含镉废电池含镉量很少,需进行回收处理
C.PFS是铁显+2价的一种碱式硫酸盐聚合物
D. 核素原子中的电子数为48,中子数为60
核素原子中的电子数为48,中子数为60
22.(10分)在80℃时,0.40mol的N2O气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s)n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
N(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
N(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s-40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度
B. 向混合气体中通入NO2
C. 使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。

21.(10分)下图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
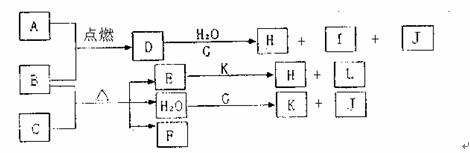
回答下列问题:
(1)K的电子式为 ,所含的化学键有 。
(2)①若D的水溶液呈棕黄色,则D的水溶液与G反应的总离子方程式为 。
②若D的水溶液呈蓝色,B与C反应的化学方程式为
。
(3)①若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的关系式为 。
②若将标准状况下2.24LF通入150mL 1mol·L-1的K溶液中。写出所得溶液中各粒子浓度关系(与①中原理不同的一个等式) 。
20.(10分)为测定碳酸钙样品(含杂质二氧化硅)的纯度,某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ:①称取碳酸钙样品mg②用c1mol·L-1盐酸V1mL(过量)溶解样品③取溶解后的溶液体积的十分之一,用c2mol·L-1NaOH溶液滴定,恰好用去V2mL
方案Ⅱ:①称取碳酸钙样品mg ②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为m1g.
方案Ⅲ:①称取碳酸钙样品mg②加入c1mol·L-1盐酸V1mL(过量)溶解样品③过滤并取出滤液④在滤液中加入过量c3mol·L-1Na2CO3溶液V3mL⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为m2g。
根据以上实验方案,回答下列问题:
(1)方案I中碳酸钙纯度计算公式为 。
(2)方案Ⅱ中高温锻烧样品应在 (填写仪器名称)中进行;为保证实验的准确性,整个实验过程中至少要称量 次。
(3)方案Ⅲ中不需要的数据是 (填选填编号)。
A.c3、V3 B.c1、V1 C.m2 D.m
(4)方案Ⅲ中为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液中体积为V3mL
B.精确配制Na2CO3溶液浓度为c3mol·L-1
C.将步骤③所得沉淀洗涤,洗液并入④中
(5)方案IV:称取碳酸钙样品mg,按下图装置进行实验,根据实验原理,在图中方框内补充必要的仪器,并注明所用试剂名称。

19.(12分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C和E两种元素相比较,非金属性较强的是(填元素名称) ,可以验证该结论的是(填写编号) ;
A.比较这两种元素的常见单质是沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均有四种元素组成),两种酸式盐相互反应的离子方程式为 。
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(4)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
②B2A4又称为肼,是一种可燃性液体,肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,该电池放电时的正极反应式为:
。
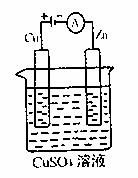
下图是一个电解装置示意图,假设使用肼-空气燃料电池作为本装置中的电源,铜片是质量128g,则肼-空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)。
18.(12分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图I-IV所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号) ;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两物质,其反应的化学方程式为 ;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号) ;
A.IV比Ⅲ复杂
B.IV比Ⅲ安全
C.IV比Ⅲ操作简便
D.IV可以 做到一套装置同时进行两个对比实验,而Ⅲ不能
(3)若用实验装置IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是 ;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应:
①当石灰水过量时,其离子方程式是 ;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为 ,请设计实验检验所得溶液中溶质的阴离子 。
17.(4分)下列说法正确的是 。
A.用托盘天平称量时,所称药品均放在纸上,并置于托盘天平的左盘
B.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
C.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
D.测定溶液的pH时,用洁净、干燥的玻璃棒醮取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E.浓硝酸与浓盐酸均易挥发,故应保存在棕色试剂瓶中,并置于阴凉处
F.用碱式滴定管量取25.00mL高锰酸钾溶液
G.不慎将少量浓碱沾在皮肤上,要立即用大量水冲洗,多后涂上硼酸溶液
H.给试管里的液体加热时,试管外壁应干燥,试管口应略向上倾斜(约45°角)
16.已知25℃时,电离常数Ka(HF)=3.6×10-4mol·L-1,溶度积常数KSP(CaF2)=1.46
×10-10mol3·L-3。现向1L 0.2mol·L-1HF溶液中加入1L 0.2mol·L-1CaCl2溶液,则下列说法中正确的是 ( )
A.25℃时,0.1mol·L-1HF溶液中pH=1
B.KSP(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生
D.以上说法均不正确
|
15.2005年1月美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构--Al13和Al14。已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态。下列说法中正确的是 ( )
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al14最外层电子数之和为42,与第IIA族元素原子的性质相似
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com