
23.向密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示。乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂(已知t0-t1阶段c(B)未画出)
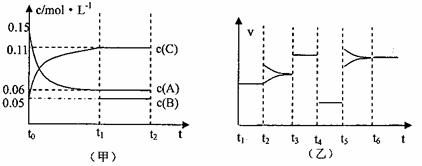
(1)若t1=15s,则t0-t1阶段以C浓度变化表示的反应速率v(C)为= 。
(2)若t2-t3阶段,C的体积分数变小,此阶段v(正) v(逆)(填“>”“<”“=”)
(3)t4-t5阶段改变的条件为 ,B的起始物质量为 。
(4)t5-t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
22.(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
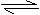 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,请写出:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,请写出:
①放电时负极的反应式 。
②放电时正极附近溶液的碱性 (填增强、减弱或不变)
(2)剪约6cm长,2cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm),将铜片与铝片分别和电流表的“+”、“-”端相连结,电流表指针调到中间位置,取50mL两只小烧杯,在一只烧杯中注入40mL浓HNO3,另一只烧杯中注入40mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为 (填“铝”或“铜”)极,铝片上的电极反应式为 。
②两电极同时插入浓HNO3中,原电池的负极为 (填“铝”或“铜”)极,铝片上的电极反应式为 。
21.(6分)在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:

 Cr2O72-+H2O 2HcrO4
2CrO42-+2H+
Cr2O72-+H2O 2HcrO4
2CrO42-+2H+
(1)加入H2SO4,使K2Cr2O7溶液的pH降低,则溶液中c(Cr2O72-)与c(CrO42-)的比值将 (填“增大”“减小”或“不变”)
(2)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液的pH下降,生成的砖红色沉淀的化学式为 。
(3)重铬酸钾在酸性溶液中是强氧化剂。例如它在H2SO4存在的条件下要把Fe2+离子氧化成Fe3+离子,本身被还原成Cr3+离子。该反应的离子方程式为 。
20.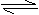 下图曲线表示可逆反应:aA+bB cC其中(A、B、C均为气体)在达到化学反应平衡前后A、C两物质在混合气体中的百分含量(分别记作A%和C%)随温度的变化
下图曲线表示可逆反应:aA+bB cC其中(A、B、C均为气体)在达到化学反应平衡前后A、C两物质在混合气体中的百分含量(分别记作A%和C%)随温度的变化
曲线如图所示,下列说法正确的是( )
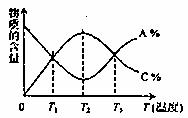
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T1温度时达到过化学平衡
C.可逆反应的正反应为放热反应
D.可逆反应的正反应为吸热反应
|
19.自1990年以来,对C60的研究报道很多,其中有碱金属K与C60在回流的甲苯中搅拦反应,得到碱金属化合物K3C60,其晶体是由K+和C603-所构成的离子晶体。右图是K3C60的一个晶体结构图,其中仅标出了C603-所构成的离子晶体。下图是K3C60的一个晶胞结构图,其中仅仅出了C603-,则在晶胞中含K+个数为 ( )
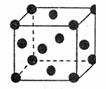
A.3个 B.4个 C.12个 D.7个
18.将0.1L含有0.2molCuSO4和0.1molNaC1的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.1molCu,另一电极析出的气体在标况下的体积为 ( )
A.2.24L B.0.224L C.0.168L D.1.68L
17.把100g密度为1.22g·cm-3的NaOH溶液蒸发浓缩,当余下溶液50mL时其物质的量浓度为8mol·L-1(蒸发浓缩时无固体析出),则原溶液的浓度为 ( )
①160g·L-1 ②3.28mol·L-1 ③4.88mol·L-1 ④16%
A.① B.②④ C.③④ D.①③
16.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.6.4g铜与足量的硫粉充分反应,转移电子数为0.2N
B.0.1molNa2O2与足量的水反应转移电子数为0.2NA
C.标准状态下,22.4L的NH3和CH4的混合气体所含的电子数为10NA
D.1molNH4+含有的共价键数为3NA
15.下列说法正确的是 ( )
A.在浓硫酸与金属铜的木炭两个反应中浓硫酸既表现酸性又表现氧化性
B.区别浓硫酸和稀硫酸的方法可以用玻璃棒各蘸少许分别滴在纸上观察观象
C.常温下,浓硫酸可用铁或铝制容器储存,说明浓硫酸不与铁、铝反应
D.6.4g铜与足量的浓硫酸完全反应,生成2.24L的气体
14.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHC1O3=bO2↑+cC12↑+dHC1O4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是 ( )
A.物质HC1O4的氧化性大于HC1O3
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:5C12+I2+6H2O=12H++10C1-+2IO3-
C.若化学计量数a=8,b=3,则该反应转移电子数为12e-
D.氯酸分解所得O2和C12的物质的量之比是确定不变的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com