
24.(7分)硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]又称莫尔盐,它是浅绿色晶体,比一般亚铁盐稳定,是常用的分析试剂。莫尔盐在水中的溶解度小于硫酸铵、硫酸亚铁。制备莫尔盐的化学方程式为:(NH4)2SO4+FeSO4+6H2O = (NH4)2Fe(SO4)2•6H2O。
某研究性学习小组设计的在实验室用废铁屑制备莫尔盐的步骤如下:
①将废铁屑放入10%的Na2CO3溶液中煮沸除油污,冷却,洗涤、倾析得铁屑;
②将处理过的铁屑放入过量的3 mol/LH2SO4溶液中,控温在50℃~60℃条件下至无气体产生,趁热过滤除去不溶于酸的杂质,得FeSO4溶液;
③将一定量硫酸铵加入到硫酸亚铁溶液中,使其完全溶解;
④从溶液中分离出莫尔盐晶体。
试回答:
(1)步骤②中存在设计缺陷,应改进为
_________________________________________________,
改进的目的是(用离子方程式表示)______________________________________________ _。
(2)步骤④从溶液中分离出莫尔盐晶体的实验操作包括
______________________________________________________________________。
(3)请设计实验,检验莫尔盐晶体中是否含有Fe3+。
_____________________________________________________________________。
23.(9分)有机物A的结构简式为:
(1)A的分子式为____________________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 molA发生反应时,最多消耗_________molNaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为___________________________________________________________________。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体。
。
(5)D的某同系物在氧气中充分燃烧生成二氧化碳和水,其中n(CO2)∶n(H2O)=3∶2,该同系物的分子式为_______________________。
22.(8分)有机物A、B、C都是重要的化工原料,A~D之间有如图所示的转化关系。
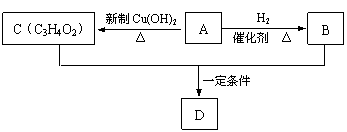

(1)A中官能团的名称为 。
(2)A→C的实验现象为 。反应的化学方程式为 。
(3)1 mol A 与2 mol H2加成得产物B。完成B+C→D的化学方程式,并指出反应类型。
,
反应类型为__________________________ _。
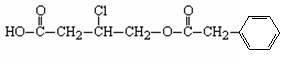
21.(9分)A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为__________________________;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为_________________________________________。
(3)A、C两元素可组成10电子粒子X-。Y与X-具有相同的原子种类及数目,且不带电,Y的电子式为_______________________。
(4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式________________________ ________。
(5)我国首创的海洋电池以E的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为_____________________________________,电池总反应的化学方程式为__________________________________________。
20.(5分)A、B、C是短周期中三种常见元素的单质。常温下D为无色液体,E是一种常见的温室气体。转化关系如图。试回答:
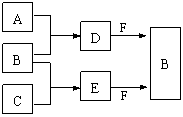

(1)A的化学式为________ __,固态E属于__________ 晶体。
(2)E的电子式为____________,D与F反应的化学方程式为_________________ 。
19.(4分)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在催化剂作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
 (1)完成反应的化学方程式。
(1)完成反应的化学方程式。
MnSO4+ K2S2O8+ ____KMnO4+ K2SO4+ H2SO4
(2)此反应的还原产物是____________________________________,当生成1 mol高锰酸钾时,共有_________mol电子转移。
18.已知2Fe2++Br2=2Fe3++2Br-。向100 mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ( )
A.2 mol/L B.1 mol/L C.0.4 mol/L D.0.2 mol/L
|
17.下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是 ( )
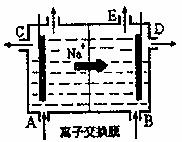
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
16.为证明某可溶性一元酸(HX)是弱酸,某同学设计了如下实验方案。其中不合理的是( )
A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸
B.室温下,将等浓度等体积的盐酸和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸
C.室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸
D.在相同条件下,对0.1 mol/L的盐酸和0.1 mol/L的HX溶液进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸
15.下列实验能达到预期目的的是 ( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将混有少量O2的N2通过灼热的氧化铜 |
除去N2中混有的少量O2 |
|
B |
C2H5Br与NaOH溶液混合后充分振荡,再加入AgNO3溶液 |
检验C2H5Br中的Br元素 |
|
C |
将Fe片放入CuSO4溶液中 |
比较Fe与Cu的金属活动性 |
|
D |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com