
8.100℃时向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述错误的是 ( )
A.此时水的离子积KW=1.0×10-14 B.水电离出的[H+]=1.0×10-10mol/L
C.水的电离度随温度升高而增大 D.[H3O+]>[SO2-4]
7.第IIA的铍在一定条件下可形成化合物Na2BeO2。下列有关铍及其化合物的叙述正确的是 ( )
A.氧化铍不能溶于盐酸
B.氢氧化铍易溶于水
C.单质铍不可溶于氢氧化钠溶液生成氢气
D.Na2BeO2溶液呈碱性
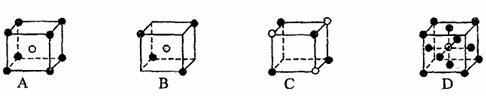
6.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为 ( )
5.下列有关碳族元素的说法错误的是 ( )
①原子最外层电子数是4
②碳与强氧化剂氯气反应时失去4个电子生成离子化合物四氯化碳
③石墨在一定条件下转化变成金刚石是化学变化
④铅的熔点比锗高,锡的沸点比铅低
⑤单质都是无色晶体
⑥从C→Pb,其最高价氧化物的水化物酸性渐强
⑦除Pb之外,其他元素的+4价化合物是稳定的
⑧稳定性SiH4<CH4<H2O<HF
⑨硅的非金属性比金属性强,而锗的金属性比非金属性强
A.全错 B.①③⑦⑧⑨ C.②④⑤⑥ D.以上答案均不合题意
4.下列各组物质中,仅用水及物质间相互反应不能一一区别的是一组是 ( )
A.Na2O2 Al2(SO4)3 MgCl2 K2CO3
B.BaCl2 Na2SO4 (NH4)2SO4 KOH
C.AgNO3 NaCl KCl CuCl2
D.Fe2(SO4)3 K2CO3 KHSO4 NH4Cl
3.下列各组物质中,不能按 (“→”表示一步完成)关系相互转互的是 ( )
|
选项 |
A |
B |
C |
D |
|
a |
HNO3 |
S |
C |
FeCl2 |
|
b |
NO |
H2S |
CO |
Fe(OH)2 |
|
c |
NO2 |
SO2 |
CO2 |
Fe(OH)3 |
2.把下列4种X的溶液:①10mL 2mol/L;②20mL 2mol/L;③10mL 4mol/L;④20mL 3mol/L,分别加进4个盛有10mL 2mol/L的盐酸的烧杯中,并均加水稀释至50mL,此时X和盐酸和缓地进行反应,则各烧杯中反应速率大小关系正确的是 ( )
 A.①<②<③<④ B.①<②=③<④ C.①=②<④<③ D.①=③<②=④
A.①<②<③<④ B.①<②=③<④ C.①=②<④<③ D.①=③<②=④
1.不久前,我国的“嫦娥”已去探月,据科学家预测月球的土壤中吸附着数百万吨的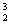 He,而在地球上氦元素主要以
He,而在地球上氦元素主要以 He的形式存在,下列说法中正确的是 ( )
He的形式存在,下列说法中正确的是 ( )
A.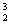 He 和
He 和 He 互为同位素 B.
He 互为同位素 B. He 比
He 比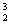 He 多一质子
He 多一质子
C. He 原子核内有4个中子 D.
He 原子核内有4个中子 D.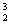 He 和
He 和 He 互为同位素异形体
He 互为同位素异形体
26.(7分)在恒温恒容的密闭容器中通入1 molN2和X molH2发生如下反应:N2+3H2 2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
(1)起始时充入H2物质的量为_____________mol;
(2)该反应的热化学方程式为_________________________________________;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。
①若维持反应向正方向进行,则起始时c的取值范围是_______________________。
②若c=2 mol,在相同条件下达到平衡时,该反应吸收的热量为______________kJ。
25.(7分)弱酸及其盐在水中存在着多种平衡关系。
(1)已知NaA水溶液呈碱性,常温下将0.10 mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
①已知该混合溶液为弱酸性,则溶液中各离子浓度由大到小的顺序为
;
②向上述混合液中再加入0.03 mol NaOH,溶液中n(A-)+n(OH-)-n(H+)=_ _mol。
(2)二氧化碳在水中除了存在H2CO3和HCO3-的电离平衡外,还存在着如下平衡:

 CO2(g) CO2(aq);CO2(aq)+H2O H2CO3(aq)。人体血液的pH通常稳定在7.35~7.45之间,这是多种因素共同作用的结果。其中,血液里存在的H2CO3-NaHCO3环境是血液pH保持稳定的重要因素,据此回答。
CO2(g) CO2(aq);CO2(aq)+H2O H2CO3(aq)。人体血液的pH通常稳定在7.35~7.45之间,这是多种因素共同作用的结果。其中,血液里存在的H2CO3-NaHCO3环境是血液pH保持稳定的重要因素,据此回答。
①当c(H+)增大时,血液中消耗H+离子的离子方程式为 ;
②当c(OH-)增大时,血液的pH也能保持基本稳定,试结合电离方程式简要说明。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com