
14.在标准状况下,向100 mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为: ( )
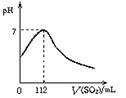
A.0.5 mol·L─1
B.0.05 mol·L─1
C.1 mol·L─1
D.0.1 mol·L─1
13.下列各种说法中错误的是: ( )
A.金刚石、石墨、C60是碳元素的同素异形体
B.目前人们发现了113种元素,但发现的原子种类数已大大超过了113种
C.二氧化硅在固态和熔融态时都不能导电
D.标准状况下,2.24 L SO3中,含硫原子数约为6.02×1022
12.下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是: ( )
A.二氧化碳、二氧化硫、一氧化碳(品红溶液)
B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.酒精、醋酸、醋酸钠(石蕊试液)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
11.下列叙述正确的是: ( )
A.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
B.加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,原溶液一定有CO32─或SO32─
C.加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42─
D.元素的非金属性越强,其气态氢化物的稳定性越强,还原性越强
9.设NA表示阿伏加德罗常数的值,下列叙述中正确的是: ( )
A.在标准状况下,V L水含有的氧原子个数为(V/22.4)NA
B.0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA
C.在常温常压下,17 g硫化氢所含质子数目为8 NA
D.在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA
|
①量取一定量液溴时,应在通风橱中小心吸取;
②容量瓶检漏:在容量瓶中按容量加足水,用手压紧瓶塞倒立1 min,如不渗漏,即可
使用;
③测量溶液的pH时,应先将pH试纸润湿;
④用溴水除去乙烯中混有的二氧化硫气体;
⑤分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出;
⑥附着于试管内壁上的硫,可用热碱液洗涤;
⑦配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸。
A.只有②⑤⑦ B.只有①⑤⑥ C.只有①②⑤⑦ D.全部
8.下列实验不能达到预期目的的是: ( )
|
代号 |
实 验 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯与溴的非金属性强弱 |
|
B |
同温下测定相同浓度的Na2CO3和Na2SO4溶液的酸碱性 |
比较硫酸与碳酸的酸性强弱 |
|
C |
AlCl3、MgCl2溶液中通入过量氨气 |
比较镁与铝单质的还原性强弱 |
|
D |
同温下用同一电路分别测定同浓度的盐酸和某一元酸溶液导电能力 |
比较该一元酸与盐酸酸性的强弱 |
7.下列分离物质的方法正确的是: ( )
A.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
B.水的沸点是100℃,酒精的沸点是78.5℃,可用直接加热蒸馏法使含水酒精变为无
水酒精
C.可用冷却热的饱和氯化钾和氯化钠的溶液的方法得到纯净的氯化钠晶体
D.由于胶体微粒的粒度比离子大,所以碘化钾混入淀粉中可用渗析法分离
6.某化学小组用下图所示装置制取氯气.下列说法不正确的是 ( )
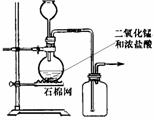
A.该装置图中至少存在三处明显错误

B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
5.下列叙述不正确的是: ( )
A.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
B.将等物质的量的Cl2和SO2分别通入到品红溶液中,均能使品红溶液褪色
C.反应AgCl + NaBr  AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
4.只给出下列甲和乙中对应的量,不能求出物质的量的是: ( )
|
|
A |
B |
C |
D |
|
甲 |
物质的粒子数 |
某条件下气体的摩尔体积 |
固体的体积 |
溶液的物质的量浓度 |
|
乙 |
阿伏加德罗常数 |
该条件下的气体体积 |
固体的密度 |
溶液的体积 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com