
27.(15分)在一定条件下进行下列可逆反应的实验:
 A(g)+2B(g) 3C(g);△H<0平行三组实验的有关条件如下表:
A(g)+2B(g) 3C(g);△H<0平行三组实验的有关条件如下表:
|
反应组别 |
温度 |
容器体积 |
起始n(A) |
起始n(B) |
其他条件 |
|
I组 |
500℃ |
1
L |
1mol |
2mol |
无 |
|
II组 |
500℃ |
1
L |
2mol |
4mol |
无 |
|
III组 |
500℃ |
1
L |
1mol |
2mol |
|
已知I组实验过程中,C气体的体积分数c%随时间t的变化如下图所示,达到平衡后C 气体的体积分数为a%,其浓度为b mol/L。
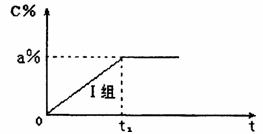
(1)请在上图中画出II组实验过程中,C气体的体积分数c%随时间t的变化的曲线。
(2)若III组实验过程中,C气体的体积分数随时间变化的曲线与II组相当,则它所具备的其他条件可能是 。
(3)在I组实验中B气体的转化率等于 。若将实验的温度变为800℃,则达平衡所需时间 (填“>”、“<”或“=”)t1,平衡时C气体的体积分数C% (填“>”、“<”或“=”)a%。
(4)保持温度500℃和1L体积不变,起始时只充入ymol的C,若达平衡后C气体的浓度依然为bmol/L,则y的值为 。若达平衡后C气体的体积分数依然为a%,则y的取值范围 。
26.(16分)有原子序数依次增大的五种短周期元素R、X、Y、Z、W,已知
①原子半径R<Y<X<W<Z
②R与Z同主族,W与Y同主族
③R、X两元素原子核内质子数之和等于Y元素原子核内质子数
④W的原子序数是Y的原子序数的2倍
回答下列问题:
(1)这五种元素的单质由固态转变为液态时,有化学键破坏的是 (填化学式)。
(2)写出任一种由R、X、Y三种元素形成的常见无机化合物 (填化学式),其溶于水后对水的电离起 作用(填“抑制”、“促进”或“不影响”),其原因是 (请用化学用语解释)。
(3)写出均由R、Y、Z、W四种元素组成的2种化合物在水溶液中发生反应的离子方程式: 。
(4)X2R4与XR3的性质相似,写出X2R4与盐酸反应的离子方程式 ;
若X2R4与盐酸反应的溶液pH=7,则溶液中c(Cl-)= 。
3.本卷共10小题,共174分
2.答卷前将密封线内的项目填写清楚。
1.用0.5mm的中性笔芯直接答在试题卷中。
13.500mL NaNO3和Cu(NO3)2的混合溶液中c(NO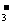 )=6mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体22.4L(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是 ( )
)=6mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体22.4L(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是 ( )
A.原混合溶液中c(Na+)=6mol/L B.电解后溶液中c(H+)=8mol/L
C.上述电解过程中共转移8mol电子 D.电解后得到的Cu的物质的量为1mol
第II卷
|
12.下列说法正确的是 ( )
A.常温下,将pH=3的盐酸与pH=b的氨水等体积混合,混合液pH=7,则b<11
B.pH=11的Na2CO3溶液加水稀释,溶液中所有的离子浓度均降低
C.常温下醋酸分子不可能存在于pH>7的碱性溶液中
D.0.1mol/L酸HA与0.1mol/L NaOH溶液等体积混合后pH>7,则
c(Na+)=c(A-)+c(HA)=0.1mol/L
11.常温下,在下列溶液中,一定能大量共存的是 ( )
A.加入FeSO4后的溶液中:K+、H+、Cl-、NO3
B.水电离的c(H+)=10-12mol/L的溶液中:Na+、Ba2+、ClO-、I-
C.能和Al反应产生氢气的溶液中:K+、Mg2+、Cl-、SO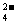
D.在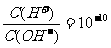 的溶液中:、Na+、Br-、AlO
的溶液中:、Na+、Br-、AlO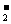 、CO
、CO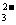
9.下列说法正确的是 ( )
A.标准状况下,22.4LCl2参加反应所得的电子数不一 定是2NA(NA为阿伏加德罗常数
B.第IA族和第VIA族元素间不可能形成原子个数比为1:1的离子化合物
C.非金属单质在固态时都属于分子晶体
D.水分子中,每个氧原子周围有4个氢原子,并分别与之形成氢键
|
 A.NaHCO3水解的离子方程式:HCO
A.NaHCO3水解的离子方程式:HCO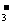 +H2O H3O++CO
+H2O H3O++CO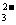
B.石灰石溶于醋酸的离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O
C.钢铁电化学腐蚀的负极反应:4OH--4e-=2H2O+O2↑
D.1 L 0.5mol/L H2SO4溶液与1 L 1.0mol/L NaOH溶液反应,放出57.3kJ的热量:
1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol
8.工业制硫酸铜不是直接用铜和浓H2SO4反应,而是将粗铜(含少量银)浸入稀H2SO4中,并不断从容器下部通入细小的空气泡。有关制备方法的叙述中,正确的是 ( )
①该方法运用了原电池工作原理 ②该方法运用了电解池工作原理 ③该方法不产生污染环境的SO2 ④该方法提高了硫酸的利用率 ⑤该方法提高了铜的利用率
A.①③⑤ B.①③④ C.②③④ D.①③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com