
3.下列说法正确的是 ( )
A.红热的铁与水反应可生成氧化铁和氢气
B.工业上可用金属铝与氧化镁熔融反应制备金属镁
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.将二氧化硫通入到紫色石蕊试液中,试液先变红后褪色
2.下列说法正确的是 ( )
A.多数合金的熔点一般比组成合金的各成分金属高
B.变色玻璃中的一种是含有溴化银和微量氧化铜的玻璃
C.红宝石、蓝宝石和金刚石都是由碳元素组成的宝石
D.光导纤维的主要成分是硅,可广泛用于通信和医疗领域
1.下列关于环境污染的说法不正确的是 ( )
A.二氧化硫、二氧化氮和二氧化碳任意排放都会导致酸雨
B.生活污水、农药和难分解有机物等会造成水体污染
C.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
D.二氧化碳和甲烷等物质的大量排放会造成温室效应的加剧
36.(9分)将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。已知加入固体A的质量m≤3.2g时,收集到的气体为氢气;当m>3.2g时,收集到的气体为H2和H2S的混合气。试分析与计算:
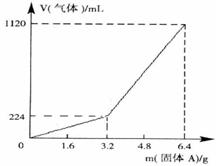
(1)3.2g固体A中所含的物质有 ,
(2)3.2g固体A中各物质的量分别为 ,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为(忽略溶液体积的变化) ;
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)V= mL(用含m的代数式表示)。
35.(13分)某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
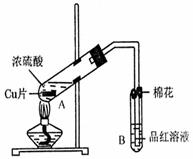
(1)写出试管B中的实验现象 。
(2)写出A中反应的化学方程式 。
(3)继续向A试管中加入H2O2,发现铜片溶解,反应的离子方程式为: 。
若仍不补充浓硫酸,只要求使铜片溶解,也可以加入(填写两种属于不同类别物质的化学式) 、 。
(4)B试管口的棉花应沾有的试剂是 。
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值。
①在他们的实验操作中,至少称量 次;
②下面是其中一次实验的数据:
|
坩埚质量 |
坩埚与晶体的总质量 |
加热后坩埚与固体总质量 |
|
11.7g |
22.7g |
18.9g |
根据上表数据计算判断x的实侧值比理论值(x=5) (填“偏大”、“偏小”),这次实验中产生误差的原因可能是 (填序号)
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
34.(8分)某待测溶液中可能含有SO42-、SO32-、CO32-、Cl-、NO3-、HCO3-等离子,进行了下述实验。(所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量)
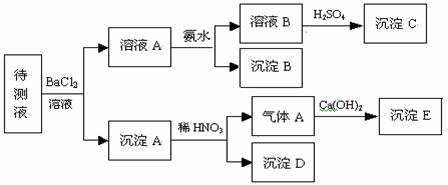
(1)判断待测液中有无SO42-、SO32-:________________;
(2)写出沉淀B的化学式:____________;
(3)沉淀C是什么物质____________;
(4)写出产生沉淀B的离子方程式:________________________________。
33.(6分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
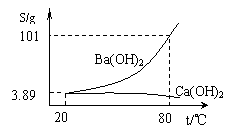

(1)高温灼烧碳酸钡和碳酸钙的混合物,直至完全分解。所需仪器除酒精喷灯、泥三角、坩埚、三脚架外还有 ;
(2)将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 ;
(3)将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
(4)向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化 碳。当观察到 时,即停止通二氧化碳。
(5)滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
32.(8分)几种短周期元素的原子半径及某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
化合价 |
–1 |
–2 |
+4、–4 |
+4、–2 |
+5、–3 |
+3 |
+2 |
+1 |
|
原子半径/nm |
0.071 |
0.074 |
0.077 |
0.102 |
0.110 |
0.143 |
0.160 |
0.186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题。涉及上述元素的答案,用元素符号表示。
(1)E元素在周期表中位于第 周期,第 族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号) ;
(3)A与J所形成化合物的晶体类型是
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为 ;D与B形成的某种化合物Y不仅能与X反应,还能与I的单质反应,则Y与I的单质反应的化学方程式为 。
31.(6分)称取一定质量的纯碱,溶于水后与盐酸反应,放出CO2,用“增多”或“减
少”填空。
(1)若纯碱中含NaCl,则所需盐酸用量___________,产生的气体____ ________。
(2)若纯碱中含K2CO3,则所需盐酸用量__________ ,产生的气体________________。
(3)若纯碱中含NaHCO3,则所需盐酸用量__________ ,产生的气体____________ 。
30.含8.0g NaOH的溶液中通入一定量的H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是 ( )
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和NaHS
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com