
1.下列有关钠的叙述中,错误的是 ( )
A.钠的质地软,可用小刀切割
B.钠是一种灰黑色的固体
C.钠的还原性很强,可以用来冶炼金属钛、锆、泥等
D.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
22.向盛有VLNaHSO4和Na2SO4混合溶液的烧杯中不断加入Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为2VL。溶液中产生沉淀的物质的量与溶液的pH变化如图。求原溶液中NaHSO4、Na2SO4 及所加Ba(OH)2三者的物质的量浓度。
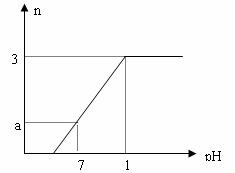
(1) c(NaHSO4)__________________
(2)c(Na2SO4)___________________
(3)c(Ba(OH)2)__________________
21.根据下列叙述回答(1)~(3)题。
在一个容积固定的反应容器有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆
反应:
|
2A(g)+B(g)≒2C(g) |
|
D(g)+3E(g)≒2F(g) |
各物质的起始加入量如下:A、B、C、D、E、F的物质的量分别为2mol,1mol,0 mol,Xmol,Ymol,Zmol,两边反应达平衡后,隔板恰好在正中间的位置。
(1)恒温时,若向左边容器中充入0.3mol He(He不与A、B、C、D、E、F反应),下列说法正确的是
A.A的物质的量增加 B.B的转化率增大
C.C的物质的量不变 D.F的浓度,体积分数一定都增大
(2)恒温时,若向左边容器中通人的不是He,而是2 molA和1mol B的气体,则下列说法正确的是
A.A的体积分数不变
B.B的转化率降低
C.C的体积分数、浓度都增大
D.右边容器中气体平均相对分子质量增加
(3)恒温时在(2)题的平衡体系中,若向左右两容器中同时再各注入lmolHe,平衡后与(2)题的平衡体系相比,下列说法正确的是
A.C、F的浓度都不变
B.B的转化率,F的分解率都增加了
C.A、D物质的量都增加了
D.A、B、C、D、E、F物质的量都不变
20.在425℃时,在1升密闭容器中进行的反应 H2(g)+I2(g)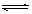 2HI(g) 达到平衡,分析下面示意图后,
2HI(g) 达到平衡,分析下面示意图后,
(1)从下列选项中选出能从示意图中读出相关信息的选项________________(填选项号)
(2)除(1)选出的选项,还能从示意图读出的信息是_____________________________。
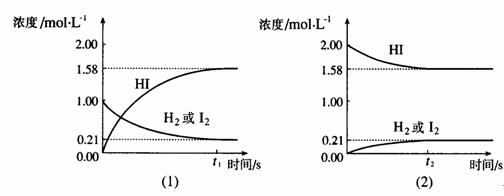
A.同温同压下,从正、逆方向都可以建立平衡。
B.同温下,当三种物质状态为气态时,压强改变对平衡无影响 。
C.此可逆反应的正反应进行程度更深 ,正反应方向为主要反应。
D.当三种物质状态为气态时,温度改变但气体体积不变。
E.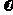 HI :
HI :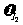 :
: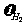 =2:1:1
=2:1:1
F.相同条件下,分别从正、逆方向建立等同的平衡状态,所须时间可能不同。
19.现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示。
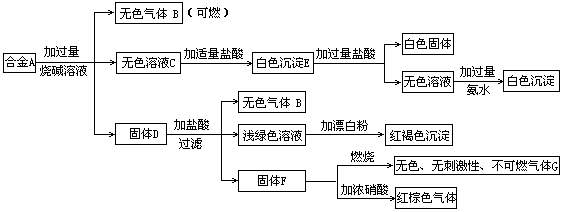
填写下列空白:
(1)A中含单质为为 (写化学式);G的电子式为 。
(2)写出A中的某单质与烧碱溶液反应的离子方程式_____ _.
(3)写出固体F与硝酸反应的化学方程式,并标出电子转移的方向和数目
。
18.常温下有浓度均为0.5mol·L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(Ⅰ)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(Ⅱ)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。
(Ⅲ)取适量溶液④,加入少量氯化铵固体,此时溶液中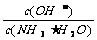 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(Ⅳ)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
。
(Ⅴ)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
17.对于反应:N2+3H2≒2NH3(正反应为放热反应),请从以下选项中选择填空(填写编号,多选倒扣分)。
(Ⅰ)其他条件不变能使反应速率增大的因素有 ,
(Ⅱ)其他条件不变能使平衡向正反应方向移动的因素有 。
①增大N2或H2的浓度 ②增大压强(缩小容积) ③降低温度
④加(正)催化剂 ⑤增大NH3的浓度 ⑥减小NH3的浓度
⑦保持容积不变,充入氩气 ⑧保持压强不变,充入氩气
16.浓度均为0.1mol/L的(NH4)2SO4、NaOH、NaHSO4、Na2SO4溶液,分别从25℃升到 95℃,其中pH值变化不大的是(物质的蒸发及溶液的体积变化忽略) ( )
A.(NH4)2SO4 B.NaOH C.NaHSO4 D.Na2SO4
15.一个带活塞的密闭容器中,盛有A、B组成的混合气体,从状态I自发反应到状态Ⅱ的变化曲线如图,则该反应过程A(g)+B(g)  2C(g)是
( )
2C(g)是
( )
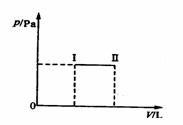
A.放热反应
B.吸热反应
C.状态Ⅱ达到化学平衡状态
D.状态Ⅱ一定达到化学平衡状态
14.在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197 kJ/mol 现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应 放出的热量(Q)如下表所列:
2SO3(g);△H=-197 kJ/mol 现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应 放出的热量(Q)如下表所列:
|
容器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是 ( )
A.2Q2=2Q3<Q1<197 kJ
B.在上述条件下每摩该反应进行到底时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.Q1=2Q2=2Q3<197
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com