
1.下列说法正确的是 ( )
A.SO2、CO2、HD都属于非电解质
B.1molH2与O2反应放出的热就是H2的燃烧热
C.足量的CO2、SO2分别通入Ba(NO3)2溶液中产生不同的现象
D.NH3、H2O2、N2H4、F2具有相同的电子数
21.(14分)北京市场销售有某种食用精制盐馐袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以Ⅰ计) |
20-50mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
KIO3+ K1+ H2SO4= K2SO4+
I2+ H2O
(2)上述反应生成的I2可用四氯化碳吸收。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①(2分)Na2SO3稀溶液与I2反应的离子方程式是 。
②(2分)某同这设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量的Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀疏酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3的溶液10mL,恰好反应完全。
①(2分)判断c中反应恰好完全依据的现象是 。
②(2分)b中反应产生的I2的物质的量是 mol。
③(3分)根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。
20.(15分)由白色和黑色固体组成的混合物A,可以发生如下框图所示的一系列变化。
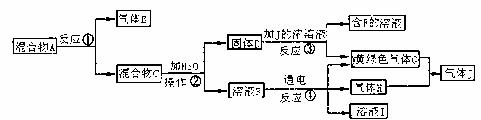
(1)(6分)写出反应①的化学方程式: ;反应③的化学方程式: ,反应④的离子方程式是: 。
(2)(4分)操作②中的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)(3分)下列实验装置中可用于实验室制取气体G的发生装置是 ;为了得到纯净干燥的气体G,可将气体通过c和d装置,c装置中存放的试剂是 ,d装置中存放的试剂是 。
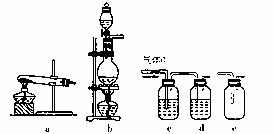
(4)(2分)气体G有毒,为了防止污染环境,必须将尾气进行处理,请写出实验室利用烧碱溶液吸收气体G的离子方程式 。
19.(9分)有X、Y、Z三种元素,已知①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;气态单质Y与X的气态氢化物能发生置换反应②Z与Y可组成化合物ZY3、ZY3溶液遇苯酚呈紫色。请回答:
(1)Y元素是 (写元素符合);Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 ,此液体具有的性质是 (填写字母序号)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通过直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol该气体与1molO2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为 。
18.(8分)有一种稀溶液,含有阳离子为A13+、Fe3+、Mg2+和Na+等四种,现用下图所示的方法将它们分离并分别得到Fe2(SO4)3、A1C13、Mg(NO3)2和含Na+的溶液。(已知Mg(HCO3)2溶于水)
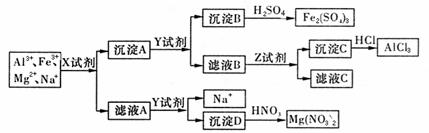
请填写下列空白:
(1)X试剂是常用的可溶性酸式盐,X是 。
(2)Y试剂是 。
(3)Z试剂最好是 。
滤液B跟过量Z试剂反应的离子方程式是: 。
17.(6分)同温同压下,(1)同体积的氨气和甲烷的质量比为 ;(2分)同质量的氨气和甲烷的体积比为 ,它们含有的氢原子个数比为 。
16.将F2通入到热的NaOH溶液中可发生氧化还原反应,其中F2和NaOH等物质量进行反应,生成物中有NaF、H2O和另一种气体,则该气体可能是 ( )
A.H2 B.HF C.OF2 D.O2
|
15.一定温度下,wg下列物质在足量氧气中充分燃烧,产物与过量的Na2O2完全反应,过氧化钠固体增重wg,符合此要求的是 ( )
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④、⑤ C.仅①、②、③ D.除⑤外
14.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为:5KC1O3+6P
3P2O5+5KC1,下列有关叙述正确的是 ( )
A.上述反应中氧化剂和还原剂的物质的量之比为6:5
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.上述反应中消耗2molP时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
13.将标准状况下的VLHC1(气)溶于1000g水中,得到的盐酸密度为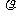 g/cm3,则该盐酸的物质的量浓度为 ( )
g/cm3,则该盐酸的物质的量浓度为 ( )
A.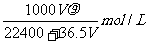 B.
B.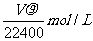
C.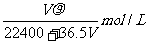 D.
D.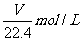
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com