
3.下列各组中两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2
B.质量相同、密度不等的N2和C2H4
C.体积相等、密度相等的CO和C2H2
D.压强相同、体积相同的O2和N2
2.下列对生产、生活有关化学问题的分析正确的是 ( )
A.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3
B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
C.金属容器和玻璃容器都可用来盛装氨水
D.液氯罐中的液氯泄漏时,可将其移入水塘中,并向水塘中加入生石灰
1.关于锂、钠、钾、铷、铯的性质递变规律,不正确的叙述是 ( )
A.单质的密度依次增大 B.单质的熔沸点依次降低
C.单质的还原性依次增强 D.离子的氧化性依次减弱
24.(7分)无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。某学生试图用下图所示装置来确定该化学反应中各物质的计量关系。
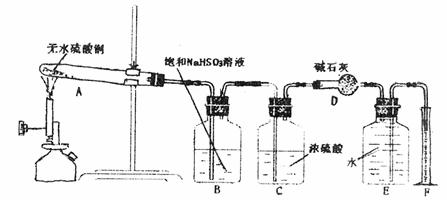
试回答:
(1)加热过程中,试管A中发生的实验现象可能有 。
(2)装置E和F的作用是 ;
(3)该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确吗?为什么?
(4)该学生使用装置C的本意是想用C来除去混合气体中的水分,这种做法有无必要?为什么?
(5)另一学生将4.8g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为 mol,三氧化硫为 mol。
(6)由上述实验数据可知无水硫酸铜受热分解的化学方程式为
。
23.(5分)A、B、C、D、E五种物质均含有同一种元素,它们能发生如下图所示的变化。
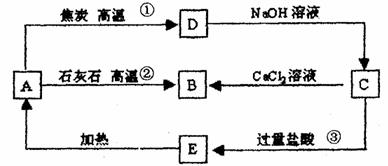
分别写出①、②、③中发生的化学反应方程式
22.(8分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G是工业上重要的碱性物质,它们有下图所示的关系。
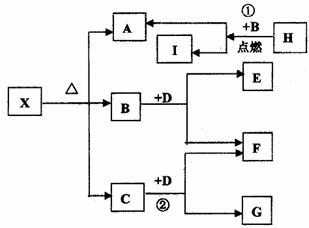
(1)B的结构式 。
(2)写出下列反应的化学方程式:
①
②
(3)X在医药上用作解释酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3:8,则X与盐酸反应的化学方程式为: 。
21.(10分)有A、B、C、D、E、F六种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体;B原子最外层电子数是次外层电子数的3倍,C2+与B元素的离子具有相同的电子层结构;D与E原子具有相同的电子层数,其次外层电子数均为8;在同周期主族元素中原子半径E最大,D最小。
回答下列问题:
(1)A、B两种元素均可与F构成非极性分子,分子式分别是 和 。
(2)画出C2+的结构示意图: 。
(3)用电子式表示C、D形成化合物的过程 。
(4)由这种五元素中的几种相结合可生成的最强的含氧酸的名称为 。
20.(6分)X、Y、Z、W均为短周期元素,且原子序数依次递增,现有A、B、C、D、E五种物质均含元素W,有的还可能含有元素X、Y、Z。
①X、Z是同族元素,Y与W也是同族元素,X的电子层数与核外电子总数相同。
②常温常压时,B、C为气体,B、C混合时有淡黄色固体A析出。
③元素W在D中呈现最高正价,D的稀溶液与盐E的溶液反应时,产物中有B生成。
④用氯水漂白的布,为了除去多余的氯气,可在碱性条件下(如氢氧化钠溶液),加入盐E,其产物中有一种含元素W的物质,W在该物质中呈现最高正价。
(1)物质C的电子式是 ;
(2)写出②中反应的化学方程式 ;
(3)写出④中反应的离子方程式 。
19.(10分)根据已知内容填空
(1)目前人类已发现的非金属元素除稀有气体外,共有16种,这16种中 族所含种类最多。
(2)写出表示含8个中子的碳原子的符号 。
(3)有下列八种晶体:A.水晶. B.冰醋酸.C.氧化镁.D.白磷.E.晶体氩.F.氯化氨.G.铝.H.金刚石。用序号回答下列问题:直接由原子构成的分子晶体 ;在一定条件下能导电的是 ,受热熔化后化学键不发生变化的是 。
18.往下列溶液中通入足量CO2,最终溶液中没有固体物质析出的是 ( )
A.次氯酸钙溶液 B.偏铝酸钠溶液
C.硅酸钠溶液 D.饱和碳酸钠溶液
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com