
18.(9分)
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水。下图为离子交换膜法电解原理示意图:
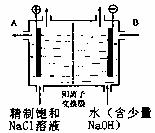
请回答下列问题:
(1)A极为电解槽的 极(正、负、阴、阳),电极反应式为 。
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许 (填 离子符号,下同)通过,而不允许 和气体通过。
(3)电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、 Mg2+ 、 Fe3+、 SO42-等杂质,因此必须精制。精制时所用试剂为① NaOH ② Na2CO3 ③ BaCl2
④盐酸, 这四种试剂的添加顺序为 (填序号)。
(4)若将标准状况下6.72升阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,电子转移数是0.5 × 6.02 × 1023,产物中得到了两种含氯化合物,写出该反应的离子方程式: 。
17.(10分)
A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子),其中
① A+、B2-、F3+核外电子层结构相同
② C-是由两种元素组成的
③ D是两种元素组成的四原子分子
④ E在常温下是无色液体
⑤往含 F3+的溶液中滴加含C-的溶液,先有白色沉淀生成,继续滴加后,白色沉淀消失
请回答:
(1)写出下列粒子的元素符号:
A B F 。
(2)E的电子式 。
(3)D的晶体类型为 ,将D通入E中所得的溶液显碱性,用化学方程式和离子方程式解释其原因: 。
(4)写出 F3+和含过量C-的溶液反应的离子方程式:
。
16.一定条件下,可逆反应 X(s)+Y(g) W(g)+Z(g)(正反应是放热反应),在一体积不变的容器中反应达到平衡后,改变条件,反应速率(v)随时间变(t)化的情况如下图所示:
W(g)+Z(g)(正反应是放热反应),在一体积不变的容器中反应达到平衡后,改变条件,反应速率(v)随时间变(t)化的情况如下图所示:
下列条件的改变与图中情况相符的是 ( )
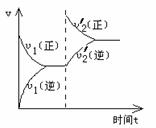
A.增加了X的物质的量
B.降低了温度
C.增大了压强
D.增大了Y的物质的量
|
15.在4个密闭容器中分别充入N2、O2、CO、CO2四种气体,当它们的温度、体积和密度都相同时,压强最小的是 ( )
A.O2 B.N2 C.CO2 D.CO
14. 常温下,将醋酸和氢氧化钠溶液混合,所得溶液 pH=7,下列叙述正确的是 ( )
A.若浓度相同,混合时V(NaOH)> V(CH3COOH)
B.若体积相同,混合时c(CH3COOH)< c(NaOH)
C.混合后的溶液中溶质既有CH3COONa又有CH3COOH
D.无法确定混合后的溶液中c (CH3COO-)与c (Na+)的关系
13.下列各组的两种固态物质熔化时,克服微粒间的相互作用属于同种类型的是 ( )
A.冰醋酸和硬脂酸甘油酯
B.金刚石和石灰石
C.三氧化硫和氯化钠
D.碳酸钠和二氧化硅
12.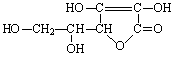 维生素C的结构简式为
,有关它的叙述 ( )
维生素C的结构简式为
,有关它的叙述 ( )
正确的是
A.1 mol 维生素C可与2 mol Br2 发生加成反应
B.可以进行氧化反应,不能进行消去反应
C.易溶于四氯化碳,难溶于水
D.在氢氧化钠溶液中不能稳定存在
11.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.在1 L 1mol / L 的AlCl3 溶液中,Al3+和Cl-离子总数为4NA
B.标准状况下,1 L辛烷完全燃烧后,所生成气态产物的分子数为8/22.4NA
C.活泼金属从盐酸中置换出1 mol H2,发生转移的电子数为2NA
D.常温常压下,1 mol氦气含有的电子数为4NA
9.在测定硫酸铜晶体结晶水含量的实验中,叙述正确的是 ( )
A.铁架台、干燥管都是实验中必须使用的仪器
B.测定结晶水含量时称量次数不得少于三次
C.加热时坩埚中的药品刚变白就立即停止加热
D-加热后的药品应在空气中自然冷却后再称量
|
A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.ⅤⅡA族元素中,非金属性最强的元素其无氧酸酸性也最强
D.第三周期元素的离子半径从左到右逐渐减小
8.电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH。其电极反应式为:Zn + 2OH- = ZnO + H2O + 2e-
Ag2O + H2O + 2e- = 2 Ag + 2OH-
下列叙述正确的是 ( )
A.负极反应为 Ag2O + H2O + 2e- = 2 Ag + 2OH-
B.负极材料是ZnO,正极材料是Ag2O
C.电流方向是由Zn到Ag2O
D.电池总反应为Zn + Ag2O = ZnO + 2Ag
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com