
14.在2L的密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g) zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L-1·min-1。则下列说法正确的是 ( )
zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L-1·min-1。则下列说法正确的是 ( )
A.z=4B B.的转化率是20%
C.A的平衡浓度是1.6mol·L-1 D.平衡时气体压强是原来的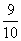
13.下列各组离子,在指定环境中一定能大量共存的是 ( )
A.能使pH试纸变深蓝色的溶液中:S2-、SO32-、SO42-
B.加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3-
C.pH=7的溶液中:Al3+、K+、SO42-、HCO3-
D.由水电离出的[OH-]=10-13mol·L-1的溶液中:Fe3+、NH4+、ClO-、Cl-
12.如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。下列说法正确的是( )
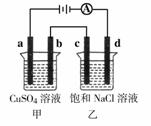
A.甲、乙两烧杯中溶液的pH均保持不变
B.乙烧杯中d的电极反应为2Cl- Cl2↑+2e-
Cl2↑+2e-
C.乙烧杯中通入适量HCl气体,溶液组成可以恢复
D.a极产生11.2L(标准状况)气体时,c极产生2g气体
11.下列离子方程式中,正确的是 ( )
A.Ca(HSO3)2固体放入稀硝酸溶液中:H++HSO3-===H2O+SO2↑
B.把Na2O2投入到FeCl2溶液中:
2Na2O2+2Fe2++2H2O===2Fe(OH)2↓+4Na++O2↑
C.澄清石灰水与醋酸溶液混合:OH-+CH3COOH === CH3COO-+H2O
D.向Ca(HCO3)2溶液中加入含等物质的量溶质的氢氧化钠溶液
Ca2++2HCO3-+2OH-===CaCO3↓+2H2O+CO32-
10.已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) △H1=-870.3kJ·mol-1
(2)C(s)+O2(g)===CO2(g) △H2=-393.5kJ·mol-1
(3)H2(g)+O2(g)===H2O(l) △H3=-285.8kJ·mol-1,
|
A.488.3 kJ·mol-1 B.-244.15 kJ·mol-1
C.244.15kJ·mol-1 D.-488.3kJ·mol-1
0.2NA
C.在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
D.1 mol Cl2发生反应时,转移的电子数一定是2NA
9.用NA表示阿伏加德罗常数的数值,下列叙述中正确的是 ( )
A.常温常压下,1 mol羟基(-OH)所含的电子数为10NA
B.由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子
8.氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3==N2+6HCl检查氯气管道是否漏气。下列说法错误的是 ( )
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1 mol N2有6 mol e-转移
7.下列除去杂质的过程中,所选择的试剂正确的是 ( )
①除去甲烷中少量的乙烯;可在光照条件下通入氯气
②除去乙酸乙酯中少量的乙酸;用饱和碳酸钠溶液洗涤
③除去CO2中少量的SO2;通过盛饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的乙酸;加足量生石灰
A.①② B.②④ C.③④ D.②③
6.类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列各说法中,正确的是 ( )
A.HCl的水溶液呈强酸性,HF的水溶液也呈强酸性
B.CH4是正四面体结构,SiH4也是正四面体结构
C.O2与Cu反应生成CuO,S与Cu反应也生成CuS
D.钠与水反应生成NaOH和H2;金属与水反应都生成碱和H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com