
3.下列离子方程式正确的是 .................. ( )
A.氯化铵与氢氧化钠两种浓溶液混合加热:NH++OH- NH3↑+H2O
NH3↑+H2O
B.溴化钠溶液中通入氯气:Br-+Cl2=Br2+Cl-
C.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.将石灰石放入稀盐酸中:CO32-+2H+=H2O+CO2↑
2.在反应3Cl2+6KOH=KClO3+5KCl+3H2O中,得电子与失电子的原子个数比是 ( )
A.5:1 B.1:5 C.3:1 D.2:1
1.下列氧化还原反应中,水既不是氧化剂又不是还原剂的是 .................. ( )
A.2Na+2H2O=2NaOH+H2↑ B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2 D.Cl2+H2O=HCl+HClO
22.(8分)将1L由CO和某常温下为气态的烯烃组成的混合气体与9L氧气混合点燃,充分反应后,测得气体总体积为10L(同温同压下测定,水为气态)。试求该烯烃的可能分子式及体积分数。
21.(12分) 某课外活动小组同学,在老师指导下,进行乙醇催化氧化制取乙醛,并探究乙醛发生银镜反应的最佳实验条件。7.00
I.制取乙醛。拟用右下图(图中铁架台等装置已略去)装置制取乙醛。
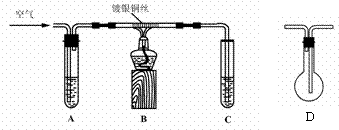

(1)实验前,首先检查装置的气密性,其操作是___________。
(2)分别向试管A中加入乙醇(乙醇沸点为78.50C),C中加入水。实验时,先加热B装置中的玻璃管,约1 min后鼓入空气,此时铜丝即呈红热状态。该反应的化学方程式为_________________________。
(3)撤走酒精灯,若反应物的流量控制适当,铜丝能长时间保持红热直到实验结束;若反应物量不足,铜丝红热现象就消失。如果需要提高产生乙醇蒸气的速率,可采用的方法是_____________。
(4)认真研究该实验方案后,某同学认为装置中存在不安全之处,建议装置B、C之间接上D装置,你认为这一改进是否合理_______(填“合理”或“不合理”),其理由是___________________________________________________________________。
II.探究银镜反应的最佳实验条件。制得的乙醛是一种常用的有机试剂,在碱性和加热条件下,能与银氨溶液发生银镜反应。银镜的光亮程度与反应条件有关。
(5)在一定条件下进行分组实验,部分实验数据录入下表:
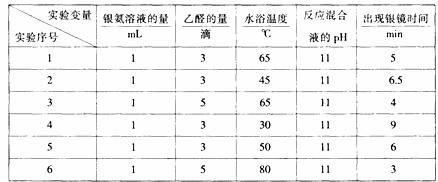
若只进行实验1和实验3,其探究的目的是 。
(6)若还要探究银氨溶液的用量对出现银镜快慢的影响,需要控制的实验条件是 。
20.化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3).
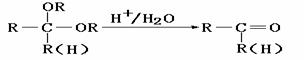
已知:
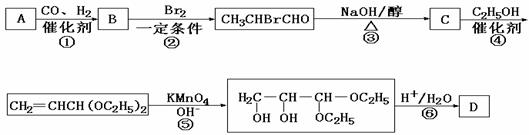
请回答下列问题:
(1)写出下列物质的结构简式:
A:__________;B:____________;C:_____________;D:___________.
(2)指出反应②的反应类型______________________.
(3)写出反应③的化学方程式___________________________________________.
(4)反应④的目的是___________________________________________________.
(5)化合物D’是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物.D’在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4).请分别写出D’生成E和F的化学方程式:
D’→E:___________________________________________________________.
D’→F:___________________________________________________________.
环戊酯是合成某些高分子材料和药物的重要中间体。某实验室以溴代甲基环戊烷为原料合成,请用合成反应流程图表示出最合理的合成方案(注明反应条件)。


提示:①合成过程中无机试剂任选,
②Ⅱ、R-CH=CH-R’ 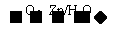 R-CHO+R’-CHO;
R-CHO+R’-CHO;
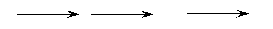 ③合成反应流程图表示方法示例如下:
③合成反应流程图表示方法示例如下:








 四、实验题
四、实验题
19. (12分)将羧酸的碱金属盐溶液电解可得到烃类化合物。例如:
(12分)将羧酸的碱金属盐溶液电解可得到烃类化合物。例如:
2CH3COOK(溶液)+2H2O C2H6+2CO2↑+H2↑+2KOH
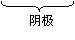

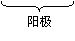
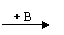
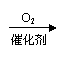
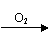
 根据下列转化关系回答有关问题:
根据下列转化关系回答有关问题:
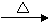 ClCH2COOK(溶液) A混合物
B
C D E
ClCH2COOK(溶液) A混合物
B
C D E
(1)写出电极反应式:阳极 ___________________, 阴极 _______________________。
 (2)写出A B的化学方程式 ______________________。
(2)写出A B的化学方程式 ______________________。
(3)D和B在不同条件下反应,会生成三种不同的E。试写出它们的结构简式:
链状E _______________,环状E _______________,高分子E ________________。
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为:
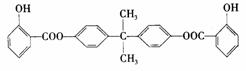
已知G不能发生银镜反应。BAD的合成路线如下:
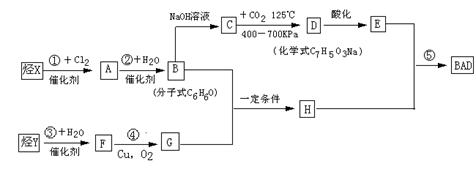
试回答下列问题
(1)写出结构简式:Y ;D 。
(2)属于取代反应的有 (填数字序号)。
(3)1 mol BAD最多可与含 mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④: ;
B+G→ H 。
18.(8分)
已知:①在有机物结构里,只要有一个碳原子连接四个互不相同的原子或原子团,(如图Ⅰ)这类物质就具有光学活性;②军事上的“地表伪装”是使军事保护设施的外观色彩红外反射与环境吻合,HAST是70年代开发的新型红外伪装还原染料,其化学结构式如图Ⅱ,该染料为橄榄色或黑色。
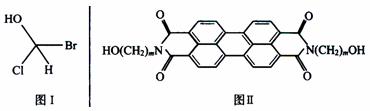
请回答:
(1)1摩尔该物质与足量金属钠反应,产生氢气的物质的量是________。
(2)当m=5时,碳原子上一个氢原子被氯取代生成的一氯代物可能有_______种同分异构体。在这些氯代物中,具有光学活性的物质有________种。
(3)当m=1时,该物质的分子式为_______________。
17.(10分)完成下列两题
(1)(4分)4月7日是“世界卫生日”。今年世界卫生日的主题是“停止排斥,敢于关怀”,强调关注人类心理健康问题。江苏等省从2004年5月起已推行以“铁强化酱油”为主的“补铁”工程。所谓铁强化酱油即在普通酱油中加入极易被人体吸收的添加剂--EDTAFeNa(乙二胺四乙酸铁钠)。试回答下列
①已知EDTAFeNa的化学式为C10H12FeN2NaO8,它是EDTA的(结构简式如下:
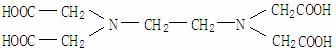 )的盐,下列说法正确的 有
。
)的盐,下列说法正确的 有
。
A.EDTA属于四元有机酸 B.铁是人体中不可缺少的微量元素
C.EDTAFeNa中铁为+3价 D.人体血液中血红蛋白中铁为+2价
(2)(6分)C1化学是指从一个碳原子的化合物(如CH4,CO,CO2 CH3OH,HCHO等)出发合成各种化学品的技术。从煤、天然气制合成气再进一步制备各种化工产品和洁净燃料,已成为当今化学工业发展的必然趋势。其中甲醇是C1化学的基础。
①CO与H2按一定比例可生成乙二醇,则n(CO)/n(H2)= 。(填数字)
②若汽油平均组成用CmHn表示,则合成汽油应控制n(CO)/n(H2)= 。(用m 、 n表示),
③甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚可生成高分子
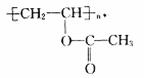 写出生成A的化学方程式
。
写出生成A的化学方程式
。
16.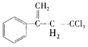
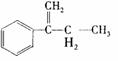
 稗草烯:α一(2,2, 2一三氯乙基)苯乙烯
,它是一种选择性内吸传导性除草剂。主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快。在同一剂量下,15℃ 以下只能起抑制作用, 25 ℃
以上 3一5 天杂草就枯死。对水稻安全,但施药期不当,用量过大、施药不均等也易产生药害。已知:同一碳原子连两个羟基基不稳定
下列说法不正确的是 ( )
稗草烯:α一(2,2, 2一三氯乙基)苯乙烯
,它是一种选择性内吸传导性除草剂。主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快。在同一剂量下,15℃ 以下只能起抑制作用, 25 ℃
以上 3一5 天杂草就枯死。对水稻安全,但施药期不当,用量过大、施药不均等也易产生药害。已知:同一碳原子连两个羟基基不稳定
下列说法不正确的是 ( )
A.该物质能使溴水褪色
 B.该物质能在碱性条件下可水解生成梭酸钠
B.该物质能在碱性条件下可水解生成梭酸钠
C.可用 在光照条件下与C2通过取代反应制得纯度较高的稗草烯
D.稗草烯在一定条件下可发生加聚反应.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com