
23.(10分)在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物。
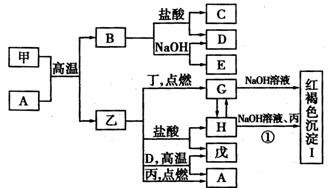
请填写下列空白:
(1)物质A的化学式是____________,乙在元素周期表中的位置是____________。
(2)甲与NaOH溶液反应的离子方程式是___________ ___________。
描述反应①发生的现象是_____________________。
(3)乙在丙、D同时存在的条件下,可发生电化学腐蚀,写出正极上的电极反应式
_____________________________________________________________________
22.(6分)某溶液由Na+ 、Cu2+ 、Fe3+、AlO2- 、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
(1)向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
(2)在(1)所得溶液中加入过量氨水,产生白色沉淀,过滤;
(3)在(2)所得的滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
(4)在(3)所得滤液中加入过量的稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述操作回答下列问题:
(1)原溶液中肯定存在的离子是_______________;
(2)原溶液中可能存在的离子是_______________;
(3)原溶液中肯定不存在的离子是________________。
21.(6分)酸碱中和滴定的实验
(1)实验中需配制0.20mol·L-1的NaOH溶液500ml,用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和 。
(2)用酸式滴定管准确量取25.00mL未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol·L-1的NaOH溶液滴定,指示剂用酚酞。滴定结果如下:
|
|
NaOH 溶液起始读数/mL |
NaOH 溶液终点读数/mL |
|
第一次 |
0.20 |
18.75 |
|
第二次 |
0.50 |
19.10 |
①根据以上数据可以计算出盐酸溶液物质的量浓度为____________mol•L-1(保留四位有效数字)。
②达到滴定终点的标志是_________________。
(3)用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸溶液,滴定过程中进行如下操作,分别指出各项操作对所测定盐酸溶液物质的量浓度的影响(填“偏高”、“偏低”、“无影响”)。
①滴定前,滴定管尖嘴处有气泡,滴定后气泡消失。________________。
②滴定前,锥形瓶用蒸馏水洗涤后,未用待测的盐酸溶液润洗就做滴定。___________。
③滴定完毕,滴定管读数时,俯视记终点。_________________。
20.(6分)某校研究性学习小组的同学对金属镁在空气中燃烧的产物进行探究。
(1)甲同学认为,空气中存在大量的氮气,镁可能和氮气反应。他设计了如下装置进行实验:
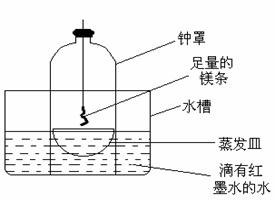
镁条燃烧完后取出蒸发皿观察,发现蒸发皿中除有白色固体外还有少量的淡黄色固体。能支持甲同学观点的实验现象除生成淡黄色固体外,还有的现象是
___________________,理由是_________________________________________;
(2)乙同学对甲同学实验中生成的淡黄色固体产生了兴趣,他向蒸发皿中的固体滴加少量水,发现有刺激性气味的气体产生,淡黄色固体转变成白色。请你写出上述过程中发生的化学反应方程式: 。
19.(4分)(1)FeCl3溶液能腐蚀铜板,发生反应的离子方程式是____________________。
(2)试写出纯碱水溶液显碱性的离子方程式:____________________。
18.做实验时不小心沾了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤,马上可以复原,其离子方程式如下,则关于此反应的叙述正确的是( )

A.该反应的氧化剂是C2O42- B.该反应右边方框内的产物是OH-
C.该反应电子转移总数是5e- D.配平该反应后,H+的系数是16
第Ⅱ卷(非选择题 共46分)
17.金属铁可与卤素单质发生化合反应,当把一定量的铁粉与碘粉混合一起研磨,生成一种Fe3I8的化合物,根据元素化合物的知识,试推断在此产物中的铁元素化合价是( )
A.+2 B.+3 C.+2、+3都有 D.无法判断
16.下列事实能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1 mol/L醋酸的pH比0.1 mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥0.1 mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦ B.③④⑥⑦ C.③④⑤⑥ D.①②
15.关于下图所示装置的叙述,正确的是( )
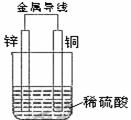
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
14.在其他条件不变时,10℃时以某物质表示的反应速率为3mol·L-1·min-1,已知某温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为 ( )
A.48 mol·L-1·min-1 B.36 mol·L-1·min-1
C.24 mol·L-1·min-1 D.12 mol·L-1·min-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com