
3.下列有关热化学方程式的叙述中,正确的是 ( )
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出 28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l)△H=十57.4 kJ/mol
B.已知C(石墨,s)=C(金刚石,s);△H> 0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g);△H=-483.6 kJ/mol,则H2的燃烧热为 241.8 kJ/mol
D.已知 2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2 则△H1<△H2
2.1772年,英国化学家普利斯特利发现了一种令人发笑的气体,“笑气”--N2O,与O2不同,N2O是一种无色带有令人愉快的甜味气体,在水中的溶解度比O2的溶解度大的多,他把一块燃着的木炭投进去,木炭燃烧更旺。26年后,普利斯特利实验室来了一位年轻的实验员--戴维,他制备了N2O并亲自嗅了几口,结果他不由自主地大声发笑、手舞足蹈,好久才安静下来。下列关于N2O的认识不正确的是 ( )
A.N2O是酸性氧化物,它能与水反应,所以在水中的溶解度比O2的溶解度大
B.N2O既具有氧化性又具有还原性,它的氧化性较强,能支持燃烧
C.N2O对大脑神经细胞有麻醉作用,在医疗上可作为麻醉剂
D.N2O与CO2是等电子体,N原子以sp杂化,N2O分子呈直线形
1.2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“水利发展与和谐社会”。下列有关活动不符合这一主题的是 ( )
A.大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放
B.大力推广使用纯净水代替自来水作生活用水,以保障用水安全
C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D.加强工业用水净化系统工程的改造,提高水的重复利用率
21.(14分)某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置对获得的铜粉(含炭)样品进行实验,图中铁架台等装置已略去,请你帮助他们完成下列实验报告。
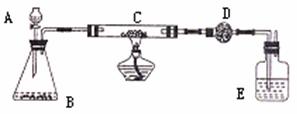
(1)实验目的: 。
(2)实验用品:
仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等。
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容:
|
实验步骤 |
实验现象 |
有关化学方程式 |
|
在G中加入样品粉末W克,D中装入药品后并称量为m1克,连接仪器后,检查气密性 |
 |
 |
|
打开A的活塞,慢慢滴加溶液 |
|
|
|
对G进行加热 当G中药品充分反应后,关闭A的活塞,停止加热 |

|

|
|
冷却后,称量D的质量为m2克 |
|
|
(4)计算:样品中铜的质量分数为 (用含W、m1、m2的代数表示)。
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使G中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是 。在B与G之间加入的装置可以是 ,其中盛放的药品是 。
(6)E中的试剂应选用 。
20.(10分)A-L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物,E的溶液遇到KSCN溶液变成红色。A-L各物质之间相互反应转化的关系如图所示(未注明必要的反应条件)。请回答:
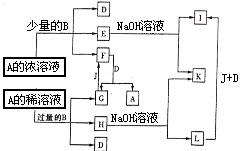
(1)B和A的浓溶液反应的条件是 ,而常温下反应难以进行的原因是 。
(2)写出F和G相互转化的化学方程式:
F→G: ;
G→F: 。
(3)写出E→I的离子方程式: 。
(4)L转化成I的现象是 ,
有关反应的化学方程式为 。
19.(10分)根据表中左栏信息,回答右栏有关问题:
|
信息 |
问题 |
|
①在短周期元素X、Y、Z、W的原子序数依将增大,它们原子的最外层电子数均不少于最内层电子数。其中X是形成化合物种类最多的元素 |
(1)X的最高价氧化物的电子式为 |
|
②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液 |
(2)Z元素在元素周期表中位于第 周期, 族 |
|
③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成 |
(3)写出生成白色沉淀的化学方程式
|
|
④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀生成 |
(4)最终生成白色沉淀的离子方程式
|
|
(5)X、Y、Z、W四种元素的原子半径由大到小的顺序为 (用元素符号表示) |
18.(8分)在起始容积为a L的甲、乙两容器中,各装入4 mol SO2和2mol O2的混合气体,发 生反应:2SO2(g) + O2(g) 2SO3(g);△H<0。在相同温度下,使其均达到平衡状态。甲是恒压容器,乙是恒容容器。甲容器经50s达到平衡状态时,测得其混合气体的物质的量为4.2mol。 请回答:
生反应:2SO2(g) + O2(g) 2SO3(g);△H<0。在相同温度下,使其均达到平衡状态。甲是恒压容器,乙是恒容容器。甲容器经50s达到平衡状态时,测得其混合气体的物质的量为4.2mol。 请回答:
(1)①在50s内,甲容器中O2的化学反应速度为 ,
甲容器达到平衡时SO2的转化率是 。
②乙容器达到平衡时所需时间 50s(填“大于”“小于”或“等于”)。
(2)达到平衡状态后,要使甲、乙两容器SO2物质的量相等,可采取的措施是 (填字母)。
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
17.(10分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
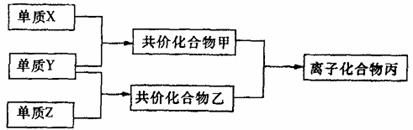
已知:甲分子含10个电子,乙分子含18个电子。
(1)X的电子式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
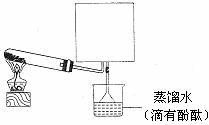
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物戊,戊的蒸汽的密度是相同状况下氢气的174倍,其化学式是 。
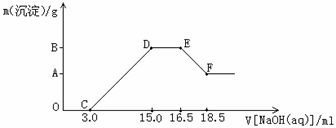
25.(5分)硝酸跟金属反应时,随着硝酸的浓度下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH3中的一种或几种。现有一定量铁粉和铝粉组成的混合物跟100ml稀硝酸充分反应,反应过程中无任何气体放出,在反应结束后的澄清溶液中,逐渐加入4.00mol/L的氢氧化钠溶液,加入氢氧化钠溶液的体积与产生沉淀的质量如图所示:
请回答:
(1)反应后的溶液中加入NaOH的溶液没有立即出现沉淀的原因是:________________。
(2)跟硝酸反应后的产物中铁元素的化合价是__________。
(3)图形中DEF先平后下折的原因是_________________________________________。
(4)纵坐标中A点的数值是________________。原稀硝酸的浓度是______________。
24.(9分)合成氨工业对化学工业和国防工业具有重要意义。
工业合成氨生产示意图如图所示。
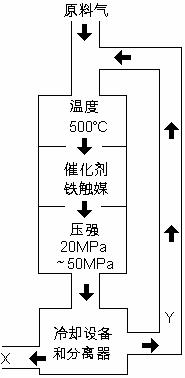
(1)X的化学式为____________;
(2)图中条件选定的主要原因是(选填字母序号)_________
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(3)改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。
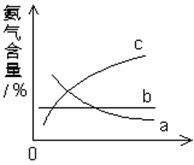
当横坐标为压强时,变化趋势正确的是(选填字母序号)____________,当横坐标为温度时,变化趋势正确的是(选填字母)__________。
(4)常温下氨气极易溶于水,其水溶液可以导电。
①用化学方程式表示氨气溶于水的过程中存在的可逆反应___________________。
②氨水中水电离出的c (OH-)__________10-7mol/L(填“>”、“<”或“=”)。
(5)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3mol A。
写出氨气和氟气反应的化学方程式__________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com