
14.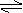 反应:xA(气)+yB(气) zC(气),达到平衡时测得A气体的浓度为0.5mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol/L,则下列叙述正确的是 ( )
反应:xA(气)+yB(气) zC(气),达到平衡时测得A气体的浓度为0.5mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol/L,则下列叙述正确的是 ( )
A.x+y<z B.平衡向右移动
C.B的转化率升高 D.C的体积分数降低
13.在下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是( )
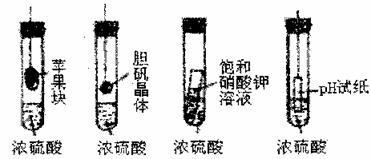
A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出 D.pH试纸变红
12.常温下,下列有关叙述正确的是 ( )
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②>③
D.10mL pH=12的氢氧化钠溶液加入pH=2的HA至pH等于7,所得溶液体积V(总)≥20mL
11.下列离子在溶液中能大量共存,且加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的是 ( )
A.Na+ 、H+ 、Cl- 、NO3- B.K+ 、Ba2+ 、OH- 、I-
C.Na+、 Mg2+ 、Cl- 、SO42- D.Cu2+ 、 S2- 、Br- 、ClO-
9.设阿伏加德罗常数的值为6.02×1023,下列叙述中正确的是 ( )
A.2.24L(标准状况)Cl2与足量Ca(OH)2在常温下反应,转移的电子数为1.2 04×1022
B.常温常压下,92gNO2和N2O4混合气体中含有的原子数为3.612×1024
C.12.5 mL 16 mol/L浓硫酸与足量铜共热,可生成SO2的分子数约为6.02×1022
D. 23 g Na和足量的O2完全反应,无论是常温,还是燃烧,都失去6.02×1023个电子
|
A.c(Na+)>c(OH-)>c(S2-) >c(HS-)
B.c(Na+)=c(H2S)+c(HS-)+c(S2-)
C.c(Na+)+ c(H+)= c(HS-)+c(S2-)+c(OH-)
D.c(S2-)+c(OH-)=c(H+)+c(H2S)
8.镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是:
Cd+2OH--2e-===Cd(OH)2;2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-。
下列说法不正确的是 ( )
 A.电池总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
A.电池总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断增大
D.电池充电时,电池负极和电源负极连接
7.室温下,pH=a的醋酸溶液与pH=b的氨水等体积混合,恰好完全反应,设醋酸溶液与氨水中分别有m%的分子和n%的分子电离,则m与n的关系正确的是 ( )
A.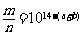 B.
B.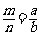 C.
C.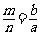 D.
D.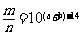
6.下列表述中正确的是 ( )
A.任何能使熵值增大的过程都能自发进行
B.已知热化学方程式2SO2(g)+O2(g) 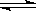 2SO3(g);△H=-QkJ·mol-1(Q>0),
2SO3(g);△H=-QkJ·mol-1(Q>0),
则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
C.在AgNO3溶液中加入过量的稀盐酸后,溶液中不存在Ag+
D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者放出的热量多
5.有以下七种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(C1O)2;④CaC12;⑤Na2CO3;⑥NaA1O2;⑦NH3和NaC1,向其中分别持续通入CO2,最终能得到沉淀或析出晶体的是 ( )
A.②④⑥ B.①⑨⑥ C.⑤⑥⑦ D.②③⑥
4.浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶液的质量分数为b%;浓度不等的两种氨水等质量混合后,其质量分数为a%,而等体积混合后,溶液的质量分数为c%,那么a、b、c数值的关系是 ( )
A.a>b>c B.b>a>c C.c>b>a D.c>a>b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com