
1.中国“嫦娥工程”的首次探月卫星于2007年10月24日成功发射,进行“月球软着陆”, 探月卫星在进入月球大气层时,由于同空气的剧烈摩擦,船体的表面温度将上升到2 000℃―3 000℃,因此卫星表面必须有良好的防高温措施, 下列有关卫星的防高温措施中不可取的是 ( )
A .使用陶瓷类的贴面覆盖船体,以防止高温侵入舱内
B.使用在一定条件下能熔化或气化的表面覆盖材料
C. 使用在一定条件下能与大气层中的氧气发生剧烈燃烧的表面覆盖材料
D. 使用在一定条件下能发生分解反应的表面覆盖材料
23.(8分)已知某固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成,通过推理和计算回答下列问题:
(1)取A与足量盐酸反应,若保持总物质的量不变,不论以何种比例混合,生成气体的量均保持不变,则混合物A的组成情况最多有 种(填数字)。
(2)取A与足量盐酸反应,若保持总质量m(A)不变,不论以何种比例混合,生成气体的量均保持不变,则A的可能组成是 和 、 和 、 和 可不填满,也可补充)。
(3)若先将A加热,剩余固体再与足量盐酸反应,且将先后两次生成的气体分别通入足量澄清石灰水中,生成的沉淀均为10.0g,则A中各物质的量之和为 mol。
(4)取ag该混合物与足量盐酸反应生成CO2气体的体积V的取值范围是(标准状况) 。
22.(11分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
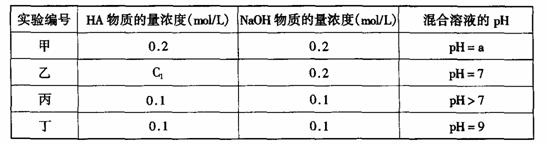
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 _______ 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。 c(Na+)-c(A-)= mol/L
21.(10分)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。
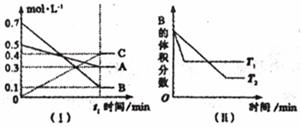
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为 ____________________________ ,正反应为 (填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆方向移动的有
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.其他条件不变,升高温度
(3)T℃时,在相同容积的1L容器中,起始充入amolA,bmolB和0.2molC于容器中,达到平衡后B的体积分数与t1时B的体积分数相同。则a= ,
b= 。
20.(11分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
|
|
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
|
|
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称
为 ;③和⑦形成的常见化合物的晶体类型是________________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为 。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(5)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。
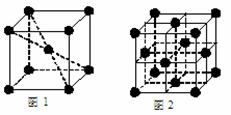
在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
19.(12分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
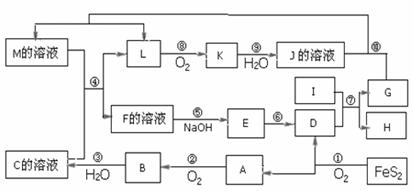
请填写下列空白:
(1)在周期表中,组成单质G的基态原子电子排布式为_____ _______。
(2)G在空气中发生吸氧腐蚀时原电池负极的电极反应式为_ ______ ___。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
(5)I与烧碱溶液反应的离子方程式是:___________________________ ________
(6)将化合物D 与KNO3、KOH 共熔,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
_____________________________________________________________________。
18.(12分)铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查寻,有两种解释:
A.因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属。
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属。
①你认为正确的说法是 。
②若有一黑色粉末,你如何鉴别是铁粉,还是Fe3O4粉末。
③若有一黑色粉末,为铁和四氧化三铁的混合物,你如何证明其中有Fe3O4(只要求简述实验方法)。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A:将三氧化二铁高温灼烧,看灼烧前后颜色是否变化。
B:将三氧化二铁高温灼烧,看灼烧前后质量是否变化。
①实验中应将Fe2O3放在 (填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由 变为 ,说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗? ,理由是 。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为 ,但是,实验结果固体灼烧前后质量比为30 :29,则高温灼烧后生成物是 。
④比较两种方法,你认为较好的方法是 。
17.(8分)下列有关实验的叙述中,合理的是 。
①用pH试纸测得氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体
③用托盘天平称量5.85 g NaCl固体配制100 mL 1 mol/LNaCl溶液
④中和热测定实验中需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体
⑥实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,
最后加入少量铁屑
⑦用酸式滴定管量取20.00mL0.1000mol·L-1的KMnO4溶液
⑧中和滴定时,左手控制滴定管活塞,右手旋摇锥形瓶,眼睛注视滴定管中液面
⑨用浓硫酸可干燥SO2气体,但不能用浓硫酸除去SO2气体中混有的SO3气体
⑩向Na2CO3与NaOH的混合溶液中只需加入酚酞试液,即可确认NaOH的存在
16.某现代化的自动酸度测定仪有自动校正温度的功能,能把不同温度下测得的pH自动校
正为常温下的数据,下列说法正确的是 ( )
A.用该仪器测定碳酸饮料,pH小于7
B.无论什么温度,该仪器测定HAc与NaAc的混合溶液,pH一定小于7
C.用该仪器测定某溶液pH等于6,该溶液在原温度下pH一定大于6
D.在80℃时,测定某溶液pH=7,若不校正,pH应小于7
|
15.用惰性电极和串联电路电解下列物质的水溶液:(1)NaCl;(2)NaNO3;(3)CuCl2;(4)AgNO3,在相同时间内生成气体的总体积(同温同压下测定),理论上由多到少的顺序是( )
A.(1)(2)(3)(4) B.(4)(1)(2)(3) C.(2)(1)(3)(4) D.(1)(2)(4)(3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com