
18.(13分)U、V、W、X、Y、Z是原子序数依次增大的六种短周期元素。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,其在W2中燃烧可生成淡黄色固体。Z的单质在W2中燃烧的产物可使品红溶液褪色。Y的单质也是一种金属,该金属在UW2中剧烈燃烧能生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;Y W的电子式为________ ____;
X在周期表中的位置为 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
(3)U、V、W分别与氢元素可形成10电子氢化物。U、V的氢化物中沸点较低的是(写化学式)__ ;V、W的氢化物分子中结合H+能力较强的是(写化学式)___ ___,请用一个离子方程式加以证明_______________________________ ____________。
(4)ZW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体VW,请用一个离子方程式表示有关反应_______ ______。
(5)已知通常状况下1g Z在W2中完全燃烧放出a kJ的热量,请写出表示Z燃烧热的热化学方程式 。
17.(8分)
A、B、C、D、E、F六种元素(前20号元素)的核电荷数依次增大。C是地壳中含量最高的元素;D的最高价氧化物的水化物分别能与E、F的最高价氧化物的水化物反应;E原子的最外层电子数是其最内层电子数的3倍;F元素是化学肥料中一种重要元素,其原子的次外层电子数与倒数第三层的电子数相等;A与F具有相同的最外层电子数;B元素的某种单质常作为干电池中的电极材料。试回答下列问题:
(1)由A、B两元素按原子个数之比为1︰1组成的某分子,其相对分子质量小于30,请写出实验室制备该物质的化学反应方程式 。
(2)D、E、F三种元素的原子半径由大到小顺序是 (用元素符号表示)。
(3)由C、D、E、F四种元素组成的某盐,可用作净水剂,也可用于制作膨化食品。该盐的化学式为 ,将该盐溶液与Ba(OH)2溶液按溶质物质的量之比1:2混合反应,此反应的离子方程式为 。
16.下列有关实验的叙述中,不正确的有( )
①乙酸乙酯中混有乙酸,可选用饱和 Na2CO3溶液洗涤,然后将两层液体分开;
②试管里加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;
③仅用蒸馏水就可鉴别蔗糖、硫酸铜粉末、碳酸钙粉末;
④溴乙烷与NaOH的乙醇溶液混合共热可得到乙烯;
⑤滴定时左手控制滴定管,右手握持锥形瓶,边滴边摇动锥形瓶,眼睛注视滴定管中的液面;
⑥用盐析法分离高级脂肪酸钠和甘油的混合溶液;
⑦用渗析法除去蛋白质胶体中混有的少量Na+和Cl-。
A.①③ B.②⑤ C.④⑥ D.②⑦
|
|
本卷共5小题,共58分。
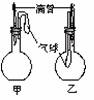
15.下图中,两电极上发生的电极反应为:a极:Cu2+ + 2 e-= Cu b极:Fe - 2 e-= Fe2+下列说法中不正确的是 ( )
A.该装置可能是电解池
B.a极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
14.下列溶液中各微粒的浓度关系正确的是 ( )
A.0.1 mol•L-1 NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+)>c(OH-)
B.0.1 mol•L-1 Na2S溶液中:2c(Na+) = c(S 2-) + c(HS-) + c(H2S)
C.0.1 mol•L-1 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:
c(Na+) = c(CH3COO-) >c(H+) = c(OH-)
13.将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)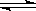 2C(g);△H <0 4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 ,下列说法中正确的是 ( )
2C(g);△H <0 4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 ,下列说法中正确的是 ( )
A.反应过程中,当A 、B、C的物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4 s 内用物质B表示的反应速率为0.075 mol·L-1·S-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大
12.珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是 ( )
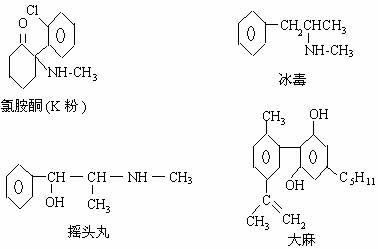
A.K粉的分子式为C13H16ClNO
B.这四种毒品都属于芳香烃
C.1mol大麻最多可与含4mol Br2 的浓溴水发生反应
D.摇头丸不可能发生加成反应
11.充分利用能源、提高原子利用率、减少向环境排放废弃物等都是“绿色化学”的基本要求。
①实验室短时间保存硫酸亚铁溶液时,向试剂瓶中添加铁钉和少量稀硫酸;
②用稀硝酸代替浓硝酸溶解、回收做银镜实验后试管内壁的银;
③接触法制硫酸的设备中安装“热交换器”和锅炉,利用余热预热冷原料气和蒸气发电; ④工业合成氨中分离产物得到氢气和氮气再循环使用。上述主要不是从“绿色化学”角度考虑的是 ( )
A.只有① B.②④ C.③④ D.②③
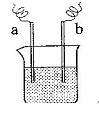
9.如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响)。则滴管和烧瓶中所用试剂可能是 ( )
A.甲:稀硫酸和铜片 乙:浓氨水和SO2
B.甲:双氧水和MnO2 乙:NaOH溶液和CO2
C.甲:NaHCO3溶液和苯酚 乙:NaOH溶液和Cl2
D.甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和N2
|
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
|
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl- Cl2↑+ Mn2+ + H2O
B.向氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4+ +2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3 +4H+ = 2Cu2+ +CO2↑+3H2O
|
Fe3++3H2O Fe(OH)3(胶体)+3H+
8.下列说法正确的是 ( )
A.碳酸氢根离子的电离方程式: HCO3-+H2O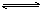 H3O++
CO32-
H3O++
CO32-
B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com