
5.根据相关化学原理,下列判断正确的是 ( )
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若A2+2D-=2A-+D2,则氧化性:D2>A2
C.若R2-和M-的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
4.在下列数量含有10电子的物质中:所含质子数由多至少的正确排列是 ( )
①质量为34.0g的氨气; ②标准状况下体积为11.2L的氟化氢;
③4℃时体积为22.4mL的纯水; ④标准状况下体积为22.4L的甲烷。
A.①>③>④>② B.②>①>③>④ C.④>②>①>③ D.①>④>③>②
3.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是 ( )
A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材料K3C60
2.元素周期表中,同周期IIA和IIIA元素原子序数差不可能是 ( )
A.1 B.10 C.11 D.25
1.2007年诺贝尔化学奖得主-德国科学家格哈德·埃特尔对有关一氧化碳在金属铂表面被氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将CO、NO、NO2和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是 ( )
A.催化转化器中的铂催化剂可加快CO被氧化
B.铂表面做成蜂窝状更有利于提高催化效果
C.在铂催化下,NO、NO2可被CO还原成N2
D.碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O
22.(共14分)
由C、H、O三种元素组成的化合物A,其蒸气密度是相同状态下H2密度的30倍。将30gA充分燃烧,产物被足量烧碱溶液吸收,烧碱溶液增重44g。已知A能与NaHCO3反应生成CO2。回答下列问题
(1)A的结构简式是
(2)有机物B与A相对分子质量相同,A和B之间能发生酯化反应,生成有机物C;B烃基上的一氯取代产物有3种。C的结构简式是
(3)有机物B在Cu做催化剂的条件下与O2反应生成D,化学方程式是
(4)有机物E是D的氧化产物,F是E的一种同分异构体,F有下图所示的转化关系:
①写出F的结构简式
②写出由X生成Y的化学方程式
③Z在一定条件下可以聚合,写出化学方程式
④已知NH3和H2O具有相似的化学性质。有机物Q可以发生水解反应,也可以发生氨解反应,写出Q发生氨解反应的化学方程式
21.(共12分)
原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式 ;其中含有的化学键是
(2)X、Z、W三种元素的最高氧化物对应的水化物酸性最强的是(填写化学式):
;
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是(填写化学式);
;
(4)与Z上下相邻的同主族元素M、N,原子电子层数M>Z>N,三种元素氢化物沸点由大到小的顺序是(填写化学式) > >
(5)元素Y的单质在一定条件下,能与氢气化合生成一种固态氢化物YH,熔点为800℃。
①YH晶体类型是
②YH能与水反应放氢气,写出化学方程式
③若将1molYH和1molAl混合加入足量水中,放出气体的体积是(标准状况下) L。
20.(共13分)
已知由短周期元素组成的A、B、C、D四种化合物所含原子数目依次为2、3、4、5,其中A、B、C、含有18个电子,D含有10个电子。请回答
(1)A、B、D的化学式分别是A ;B ;D
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式
(3)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,写出化学方程式
若C为第一和第二周期元素组成的化合物。
①C的溶液中加入少量的二氧化锰,有无色气体生成,写出化学方程式
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做 剂
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:
19.(共8分)食盐有广泛的用途
(1)写出电解饱和食盐水的离子方程式
(2)用下图所示装置电解500mL2mol·L-1食盐水可制取一种消毒液,在通电过程中不断搅拌溶液(使阳极产物全部溶解在溶液中)溶液的pH(填写字母)
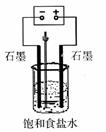
A.逐渐增大;
B.逐渐减小;
C.保持不变
当阳极有氧气生成时,停止通电最终所得溶液中的溶质主要成分是 ;
假设电解过程中阳极产物无逸出,溶液加水至500mL,消毒液的浓度是 mol·L-1
(3)向上述制取的消毒液中通入CO2气体,可以增强消毒效果,写出反应的离子方程式
18.(共6分)
已知: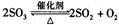
在起始时体积相同的容器A和B中,同时分别充入2molSO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间A B(大于;等于;小于)
达平衡时SO3的转化率A B(大于;等于;小于)
(2)若平衡后,向A、B中分别充入惰性气体, 容器的平衡将向 方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A ,B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com