
18.(8分)近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:
(I)将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。
(II)将电解饱和食盐水所得气体反应后制得盐酸。
(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
①写出步骤(I)反应的化学方程式: ;
②写出步骤(III)反应的离子方程式: ;
(2)某研究性学习小组采用下图装置在实验室测定废气样品(含SO2、O2、N2、CO2等)中SO2的体积分数,X溶液可能是 ;
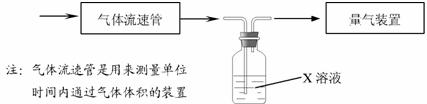
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.氯化钡溶液
17.(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)实验测得,在通常情况下,1gH2完全燃烧生成液态水,放出 142 . 9 kJ 热量。则H2燃烧的热化学方程式为
(2)用氢氧燃料电池进行下图所示实验。
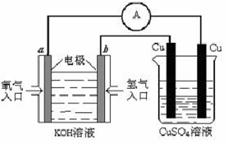
①氢氧燃料电池中,正极的电极反应式为
②右图装置中,某一铜电极的质量减轻3.2g,则a极上消耗的O2在标准状况下的体积为 L
(3)用氢气是合成氨,反应的热化学方程式如下:
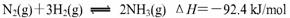
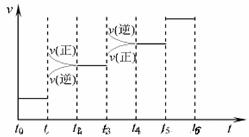
① 下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率v与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。
②温度为T℃时,将4amolH2和2amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则反应的平衡常数为 。
16.(10 分)中学化学中几种常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去):
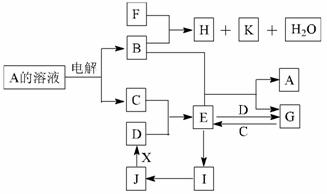
已知:B、C、D为常见单质,其中C为气体,B、D为金属;F为常见的强酸;K常温下为气体,且能使品红溶液褪色;将E的饱和溶液滴入沸水可制得一种红褐色胶体; J为红棕色固体。请回答下列问题:
(1)C的化学式为 ;
写出B与F反应的化学方程式
(2)实验中保存G溶液时要加入 目的是
(3)为实现J→D的变化,若X是非金属单质,则X可能是 (写化学式);若X是金属单质,请写出 J→D 反应的化学方程式
15.(10 分)实验室可以通过三条途径来制取N2:
①加热条件下用NH3还原CuO制得纯净的N2和铜粉,反应的化学方程式为:
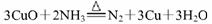
② 将空气通过灼热的铜粉制得的N2
③ 加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为:
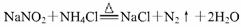
按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。
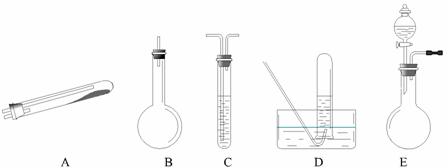
(1)按途径 ① 制取N2时所需的氨气要用浓氨水与生石灰反应得到,化学方程式为:
CaO+NH3·H2O === Ca(OH)2+NH3↑,,最好要用上述装置中的 。 (填字母,下同)作为氨气发生装置。要制取并收集N2,还应使用到上述装置中的
(2)①和②两种途径常常被联合使用。这种方法与途径③相比其优越性在于 。
(3)检查E装置气密性的方法是 。利用E装置还可以制取的气体有 (只需写出三种)。
14.向1 . 00 L0.3mol / L 的NaOH 溶液中缓慢通入8.8gCO2气体,使其完全反应,对反应后的溶液,下列判断正确的是 ( )
A.溶质为Na2CO3
B.溶质为NaHCO3
C.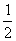 c(Na+) = c(HCO-3)+c(CO2-3)+c(H2CO3)
c(Na+) = c(HCO-3)+c(CO2-3)+c(H2CO3)
D.c(Na+)+c(H+) = c(HCO-3) + 2c(CO2-3)+c(OH-)
|
13.根据下图判断,下列说法正确的是 ( )
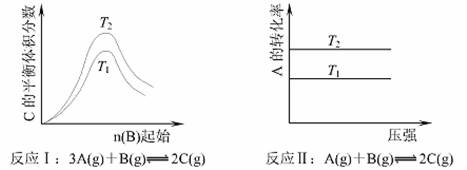
A.若反应I中的△H<0,则T2 > T1
B.若反应I中的△H>0,则T2 < T1
C.反应II的平衡不受压强的影响
D.若反应II中的△H>0,则T2 < T1
12.下列关于有机物的说法中,正确的是 ( )
A.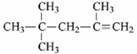 的名称为2,2,4-三甲基-4-戊烯
的名称为2,2,4-三甲基-4-戊烯
B. 互为同系物
互为同系物
C.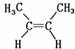 与
与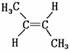 互为同分异构体
互为同分异构体
D.HCHO与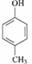 在一定条件下能发生缩聚反应生成
在一定条件下能发生缩聚反应生成 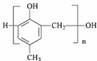
11.下列离子方程式正确的是 ( )
A.大理石溶于醋酸:
CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+H2O
B.铝与氢氧化钠溶液反应:Al+2OH- === AlO-2+H2↑
C.氯气溶于水:Cl2+H2O === 2H+ + Cl-+ClO-
D.氢氧化钡溶液与硫酸反应 Ba2+ + SO2+4 = BaSO4↓
9.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是 ( )
A.Y 元素最高价氧化物对应水化物的化学式为H2YO4
B.原子半径有小到大的顺序为:W < X < Z
C.X与W 可以形成W2X、W2X2两种物质
D.Z的气态氢化物比Y的气态氢化稳定
|
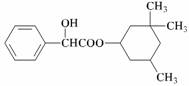
A.该物质属于芳香烃
B.该物质分子式为C17H23O3
C.该物质遇FeCl3溶液显紫色
D.1 mol 该物质水鲜时最多可消耗2 molNaOH发生反应
8.甲乙两位同学一起做水果电池的实验,测得数据如下: ( )
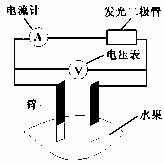
|
实验编号 |
电极材料 |
水果品种 |
电极间距/cm |
电压/mV |
|
|
1 |
锌 |
铜 |
菠萝 |
3 |
900 |
|
2 |
锌 |
铜 |
苹果 |
3 |
650 |
|
3 |
锌 |
铜 |
柑桔 |
3 |
850 |
|
4 |
锌 |
铜 |
西红柿 |
3 |
750 |
|
5 |
锌 |
铜 |
菠萝 |
3 |
650 |
|
6 |
锌 |
铜 |
苹果 |
3 |
450 |
乙同学提出的问题,乙同学解释不正确的是 ( )
|
|
甲同学 |
乙同学 |
|
A |
实验6中负极电极反应式的如何写? |
Al-3e- = Al3+ |
|
B |
实验1、5中电流方向为什么相反? |
实验1中的金属活动性比铜强,锌为负极;5实验中铝的金属活动性比锌强 |
|
C |
水果电池的电压与哪些因素有关? |
只跟水果的品种有关 |
|
D |
实验中发光二极管不亮,如何使它亮起来? |
可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com