
16.(21分)类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2。
(2)设计实验方案:
分别取A、B的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
|
实验方法 |
实验现象 |
结 论 |
|
分别向A、B溶液中加 KSCN溶液 |
|
固体物质中有FeCl3 |
|
分别向KMnO4溶液中 加适量A、B溶液 |
KMnO4溶液颜色无明显变化 |
固体物质中不含 |
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式: .
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)实际应用:
① 半导体、多媒体行业要用FeCl3溶液做印刷电路铜板腐蚀剂,请写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
② 腐蚀铜板后的混合溶液中,若Cu2+和Fe3+的浓度均为0.1mol/L,则溶液中Fe2+的浓度为 mol/L,原FeCl3溶液中Fe3+的浓度为 mol/L。
③ 请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
|
|
氢氧化物 开始沉淀时的pH 氢氧化物 |
氢氧化物 沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu |
④ 某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、 。
劣质不锈钢腐蚀的实验现象 。
15.(13分)A、B、C是三种常见元素的单质,其对应元素的原子序数依次增大,甲、乙为常见化合物。它们之间有如下转化关系:
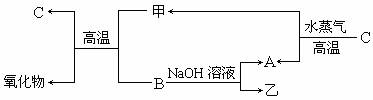
回答下列问题:
(1)甲中一定含有的元素是____________。
(2)B与NaOH溶液反应的化学方程式____________。
(3)乙的水溶液显____________性(填酸、碱或中性),原因是(用离子方程式表示)
___________________________________________________________________________。
(4)一定条件下,2 mol B与3 mol C的一种氧化物W恰好反应,则W的化学式是_____________。
14.(12分)请配平以下化学方程式,并回答下列问题:
(1)_______KClO3 +_________HCl ─→_______ Cl2 + _______ KCl + _______ H2O
(2)发生氧化反应的物质是________________,被还原的元素是_____________。
(3)反应中1 mol氧化剂_______(填"得到"或"失去")___________ mol电子。
(4)氧化产物与还原产物的物质的量之比为: ︰ 。
13.(10分)现有X2气体a L(标准状况),其摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 。
(2)该气体所含原子总数为 。
(3)该气体的质量为 。
(4)该气体溶于1L水中(不考虑气体与水的反应),其溶液中溶质的质量分数为 。
(5)该气体溶于水后形成V L溶液,其溶液中溶质的物质的量浓度为 。
12.取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
A.H2 B.CO C.CH4 D.CH2O
第Ⅱ卷 (非选择题 共64分)
11.某溶液中有①NH4+、②Cu2+、③Fe2+、④Al3+四种离子,向其中加入适量的Na2O2粉末,反应后再加入过量盐酸,溶液中大量减少的阳离子是
A.①③ B.①② C.②③ D.②④
10.下列反应的离子方程式正确的是
A.铁片插入氯化铁溶液中:Fe3++Fe=2Fe2+
B.少量金属钠放到硫酸铜溶液中:Cu2++2Na=Cu+2Na+
C.少量金属钠放到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
9.在含有1molFeBr2溶液中通入1molCl2,充分反应后产生的Br2的物质的量是
A.1mol B.0.75mol C.0.5mol D.0.25mol
8.下列反应不能够发生的是
A.2Fe+3I2=2FeI3 B.3Br2+6FeCl2=2FeBr3+4FeCl3
C.Cl2+2KBr=2KCl+Br2 D.2FeCl3+2KI=2FeCl2+2KCl+I2
7.下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素由化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
已知下列物质氧化性由强到弱的顺序是:Cl2>Br2>Fe3+>I2>Fe2+,据此回答第8、9题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com