
4.下列有关表述正确的是 ( )
A.H、D、T具有相同质子数,互为同素异形体
B.-OH 与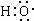 组成元素相同,含有相同的电子数
组成元素相同,含有相同的电子数
C.CH2=CHC(CH3)3与氢气完全加成后,生成3,3-二甲基丁烷
D.结构示意图为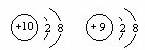 的两种粒子为同一种元素
的两种粒子为同一种元素
3.家用炒菜铁锅用水清洗放置后,出现红棕色锈斑,在此变化过程中不发生的化学变化是 ( )
A.Fe-3e-=== Fe3+ B.2Fe+2H2O+O2===2Fe(OH)2
C.2H2O+ O2+4e-===4OH- D.4Fe(OH)2+2H2O+O2===4Fe(OH) 3
2.下列各组物质中,前者是纯净物,后者是混合物的是 ( )
A.水煤气、铝热剂 B.盐酸、磷酸钙
C.硫酸铜、漂白粉 D.石油、含铁70%的氧化铁
1.下列各组变化中,前者是物理变化,后者是化学变化的是 ( )
A.分馏、干馏 B.风化、裂化 C.渗析、盐析 D.水解、电解
23.为了探究酮与浓硫酸的反应,某研究性学习小组做了如下实验:
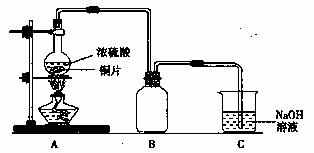
①在放有铜片的圆底烧瓶中加入10mL浓硫酸,加热煮沸10min(如右图所示)后,所得固体分离除去未反应的铜片,再经水洗仍有大量黑色不溶物。
②取少量不溶物,向其中加入几滴浓硝酸,产生大量红棕色气体。
③取少量不溶物,向其中加5mL酒精,充分振荡后,静置、过滤,把滤液移入盛有水的小试管中,振荡,出现乳白色浑浊。
④取少量不溶物,向其中加入3mL氨水,振荡,溶液呈无色,在空气中静置,溶液变为深蓝色。
⑤取少量不溶物,向其中加入浓盐酸并加热,沉淀几乎全部溶解。
为了解释上述现象,学习小组通过查阅资料了解到。
a.铜与浓硫酸反应的不溶性副产物可能有:CuS、Cu2S、Cu2O、S等物质;
b.CuS和Cu2S都能溶于热的浓盐酸;
c.Cu2O能溶于氨水生成无色的[Cu(NH3)2]+,[Cu((NH3)2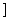 +在氨水中被空气中的氧气氧化成深蓝色的[Cu(NH3)4]2+。
+在氨水中被空气中的氧气氧化成深蓝色的[Cu(NH3)4]2+。
回答下列问题:
(1)装置图中的B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。实验结束后,装置C中的溶液中可能含有的溶质有 。
(2)第②步操作要注意的问题是 ;对比①②两步操作中的现象,你能得到的结论是 。
(3)第③步操作中出现的乳白色沉淀是 ,请解释出现这一现象的原因 。
(4)写出④步涉及的离子方程式 。
(5)综合分析铜与浓硫酸的反应,生成的不溶物是 。
(6)某工厂拟用废铜屑制备硫酸铜,请你分析利用上述实验原理是否可行。若可行,请说明理由 。
若不可行,请设计更合理的实验方案(用化学反应方程式表示) 。
22.(10分)向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
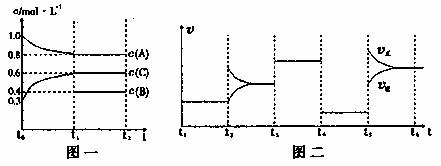
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡,a、b、c要满足的条件为 。
21.(10分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大小”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 (填序号)。
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
20.(10分)已知物质A是由三种元素组成的化合物,其焰色反应为黄色。B、C、D、K都是单质,反应①-⑤都是工业生产中常见的反应。各物质之间的相互转化关系如下图所示。
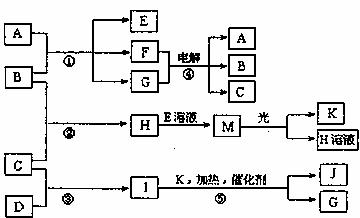
请填写下列空白:
(1)写出下列物质的化学式:B ;J 。
(2)写出反应H+E(溶液)→M的离子方程式 。
(3)写出反应④的化学方程式 ,其阴极产物为 。
(4)化学反应的焓变(△H)与反应物和生成物的键能(E)有关,已知B、C、H中化学键键能分别为274kJ·mol-1、436kJ·mol-1、434kJ·mol‑1。请计算反应②的焓变△H= 。
19.(10分)下图为元素周期表中前4周期的表格。
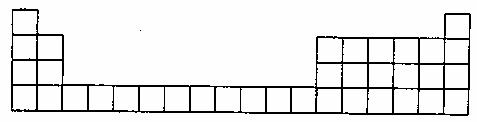
甲是一种常见化合物,其化学式为XC13。
(1)根据你所学知识,将X代表的元素符号,填在所给周期表的表格中对应的位置(要求写出2种)
(2)若将一种XC13水溶液蒸干、灼烧,得到红棕色粉末X2O3,则含碳的X合金在潮湿的空气中发生电化腐蚀时反应的化学方程式为 。
(3)若X代表另一种金属单质,该单质可与(2)中所述的粉末发生反应,则该种X元素的原子结构示意图为 ;该X单质与(2)中所述粉末组成的混合物可称为 ,该反应可用于 。(写出一种用途)。
18.用一定物质的量浓度的NaOH溶液滴定10mL一定物质的量浓度的盐酸,有关关系如图所示,据图推出NaOH溶液和盐酸的物质的量浓度是 ( )
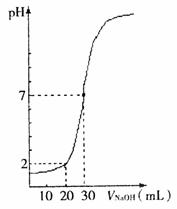
|
|
A |
B |
C |
D |
|
C(HC1)(mol·L-1) |
0.12 |
0.04 |
0.18 |
0.09 |
|
C(NaOH)(mol·L-1) |
0.04 |
0.12 |
0.06 |
0.03 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com