
17. 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
A.加少量烧碱溶液 B.降低温度
C.加少量冰醋酸 D.加水
16.在一定 定下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量变化如图所示。则下列有关推断正确的是 ( )
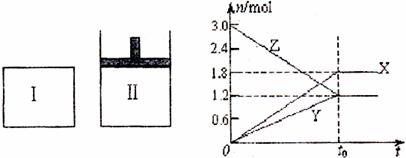
 A.该反应的化学方程式为:3X+2Y 2Z
A.该反应的化学方程式为:3X+2Y 2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y的固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
15.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1mol·L-1的NaHSO3的溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是 ( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+ c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+ c(HRO3-)= c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
14.已知G是一种具有和卤素单质相似的性质的直线型分子,J是一种角型分子,G和J按物质的量之比1:1反应后生成直线型分子L和分子M(组成G、J、L、M的元素的原子序数均小于10)。分析下图,指出下列判断中错误的是 ( )

A.常温下J是液态,能与某种活泼非金属单质气体反应,产生具有氧化性的单质气体
B.组成G的两种元素中,一种元素能与J中的两种元素分别形成直线型分子
C.L的水溶液成酸性,与等物质的量的氢氧化钠反应后的溶液呈中性
D.M可能是一种不稳定的弱酸性物质
13.1993年报导,合成了迄今为止世界上最大的烃,即C1134H1146。下列有关叙述正确的是( )
A.具有高硬度 B.属于高分子化合物
C.属于分子晶体 D.常温下呈固体
12. 一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
A.2mol C
B.2mol A、1mol B和1mol He(不参加反应
C.1mol B和1mol C
D.2mol A、3mol B和3mol C
11.A、B、C、D、E是同一周期的五种短周期元素,A和B的单质在化学反应中易失去电子形成简单离子,且B的离子半径大于A;C和D的最高价氧化物对应的水化物酸性C>D;E是这五种元素中原子半径最小的主族元素,它们的原子序数由大到小的顺序是( )
A.E、C、B、D、A B.A、B、D、C、E
C.B、A、D、C、E D.C、D、A、B、E
9.下列事实不能用勒沙特列原理解释的是 ( )
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.实验室可用排饱和食盐水的方法收集氯气
D.常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5
|
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
8.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是 ( )
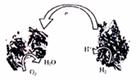
A.左边为该电池的负极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为:O2+4e-=2O2-
7.某离子化合物DxEC6,晶体结构如下图所示,阳离子D+位于正方体棱的中点和正方体内部;阴离子EC6X-位于该正方体的顶点和面心。该化合物中x值为 ( )
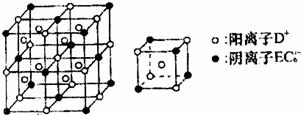
A.1 B.2 C.34 D.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com