
2.硝酸铵(NH4NO3)在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是 ( )
A.N2O、H2O B.N2、O2、H2O
C.N2、HNO3、H2O D.NH3、N2O、H2O
1.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于242 nm的紫外线形成的,不过当波长在260 nm-320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是( )
A.打雷时也能产生臭氧,臭氧分子于是直线型非极性分子
B.臭氧转化为氧气和氧气转化为臭氧的过程中均须吸收能最
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.臭氧、氧气和氧原子都是含有氧元素的物质它们互为同素异形体
25.(9分)实验室为测定一新配的稀盐酸的标准浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶解在溶液中会影响pH,为准确测定,终点pH在4-5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用 。当滴定至溶液由 色变为 色时,即表达达到终点。
(2)若达到终点时,中和W克Na2CO3消耗盐酸VmL,则盐酸的物质的量浓度为 mol/L。
(3)若所取称的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol/L,用不纯的Na2CO3标定而测得盐酸浓度为c2 mol/L。在下述情况下,c1与c2的关系是(填“>”、“<”、“=”):
①当Na2CO3含有NaHCO3时,则c1 c2;
②当Na2CO3含有NaOH时,则c1 c2。
24.(10分)某温度(t℃)下的溶液中,c(H+)=10xmol/L,c(OH-)=10ymol/L。x与y的关系如下图所示:
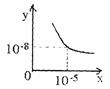
(1)此温度时,水的离子积KW为 ,则该温度 (填“>”、“<”、“=”)25℃。
若将此温度(t℃)下pH=1的苛性钠溶液a L与pH=1的稀硫酸bL混合(忽略混合后溶液体积的变化),试通过计算填写以下不同情况时两种溶液的体积比:
(2)若所得混合溶液为中性,则a:b= ;此溶液中各各离子的浓度由大到小的排列顺序是
(3)若所得混合液的pH=2,则a:b= ;此溶液中各各离子的浓度由大到小的排列顺序是
23. (7分)蓄电池是一种可反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
(7分)蓄电池是一种可反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
(1)若此蓄电不放电时,该电池某一电极发生还原反应的物质是 (填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)假如用此蓄电池分别用来电角以下两种溶液,工作一段时间后都分别消耗0.36g水,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一极增加了a g M,则金属M的相对原子质量的计算式为_________(用“a、x”表示)
②电解含有0.01mol CuSO4和0.01mol NaCl的混合溶液100mL,阳极产生标准状况气体 L;将电解后溶液加水稀释至1L,此时溶液的pH=
22. (10分)已知2NO2
N2O4(△H<0)。将NO2充入容易导热的材料制成的容器a和b中进行反应。a的容积保持不变,b的上盖(活塞)可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。在同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中反应。
(10分)已知2NO2
N2O4(△H<0)。将NO2充入容易导热的材料制成的容器a和b中进行反应。a的容积保持不变,b的上盖(活塞)可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。在同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中反应。
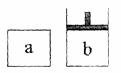
(1)反应开始时,a与b中生成N2O4的速率va vb,反应过程中生成N2O4的速率是Va Vb。(填“>”、“<”、“=”)
(2)若在a、b中再充入与初始量等量的二氧化氮,则达到平衡时a中NO2转化率 ,b中NO2转化率将 。若通入等量氮气,则达到平衡时a中NO2转化率将 ,b中NO2转化率将 。(填“变大”或“变小”或“不变”)
(3)室温下若a、b都保持容器体积不变,a与外界隔热不发生热量传递,b可与外界进行热传递,则达到平衡所需的时间ta tb(填“>”、“<”、“=”)平衡时容器_____ 中的颜色较深。(填“a”或“b”)
(4)塔在a容器中充入4.6g NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则NO2的转化率为 。
21.(14分)现有下列短周期元素性质的有关数据:
|
元素编号 |
a |
b |
c |
d |
e |
f |
g |
H |
|
原子半径 |
0.037 |
0.071 |
0.075 |
0.082 |
0.102 |
0.143 |
0.152 |
0.186 |
|
最高价或最低价 |
+1 |
-1 |
-3 |
+3 |
-2 |
+3 |
+1 |
+1 |
(1)根据元素周期律确定a~h八种元素在周期表中的位置,将他们的元素编号填入下表相应的空格内。
|
|
ⅠA族 |
ⅡA族 |
ⅢA族 |
ⅣA族 |
ⅤA族 |
ⅥA族 |
ⅦA族 |
0族 |
|
第一周期 |
|
|
|
|||||
|
第二周期 |
|
|
|
|
|
|
|
|
|
第三周期 |
|
|
|
|
|
|
|
|
(2)氢化铝锂(LiAlH4)是一种易燃、易爆具有极强还原性的物质,它在有机合成上应用广泛。在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH)。
①氢化铝锂极易不解,可得三种产物,请写出其水解的反应方程式: 。
②与氢化铝锂性质相似但较为温和的还原剂由上述a、d、h三种元素组成,该还原剂的化学式是: 。
(3)一种离子化合物A由a和c两种元素组成,两元素的原子个数比为5:1,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构。写出A的电子式:
。A物质与水反应生成一种碱和一种无色气体,写出有关化学方程式: 。该反应中的还原剂为: 。
(4)物质熔沸点的高低与该物质的晶体结构有关。d的单质晶体熔点为2573K,沸点为2823K,硬度大,则属于 晶体。某同学猜想f和b的下周期同主族元素形成的化合物B晶体类型与NaCl相同,则B的熔、沸点应 (填“高于”或“低于”)NaCl。如果用实验证明上述猜想不正确,你的实验方案是
。
20.用惰性电极电解1L 4mol/ CuSO4溶液时,在电路上通过0.5mol电子后,发现电极接反了,纠正后又通过1mol电子,此溶液中c(H+)是(假设溶液体积不变化) ( )
A.1.5mol/L B.1 mol/L C.2 mol/L D.3.5 mol/L
|
19.下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.BeCl2 B.NCl3 C.H2S D.SF6
18.在室温下,将pH=3的酸和pH=11的碱等体积混合,混合后溶液的pH小于7,则该酸和碱的组合可以是 ( )
A.硝酸和氢氧化钡 B.盐酸和氨水
C.硫酸和氢氧化钾 D.甲酸和氢氧化钠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com