
6. 下列说法中,正确的是:
A.不可能有非金属单质置换出金属单质的置换反应
B.仅由非金属元素组成的化合物一定是共价化合物
C.能用同一通式表示的几种物质一定互为同系物
D.电能与化学能的相互转化过程中一定有新物质产生
21.(4分)科学探究,如图分别实验。
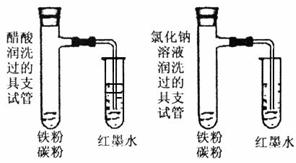
①分别用醋酸溶液、氯化钠溶液润洗两支具支试管
②用药匙取铁粉、碳粉缓慢放入具支试管中
③把具支试管固定在铁架台上
④立即用塞子塞住具支试管的试管口
⑤向小试管中滴加少量红墨水,把导
管插入到小试管中。使红墨水液面没
过导管口观察并记录,将结果记入表格内。
|
|
醋酸溶液 |
氯化钠溶液 |
|
现象 |
导管中液面: |
导管中液面: |
|
结论 |
左侧装置中: |
左侧装置中: |
20.(7分)已知:Co有+2、+3价态。向一定量的CoCO3中加入浓氢溴酸使之溶解,再加入浓氨水和NH4Br,搅拌下加入30%的H2O2,向溶液中通空气除去过量的氨气,再加浓氢溴酸到溶液为中性时开始出现红色沉淀A,A中含五种元素,其中Co为14.67%,N为17.43%,2.0gA与0.920mol/L的AgNO3溶液反应消耗16.30mL AgNO3溶液。将A过滤、洗涤、干燥,在1100C时加热1-2小时得到蓝紫色晶体B,失重率为4.48%,在B的冷浓溶液中加稀盐酸可以得到暗紫色晶体C,C中含CO为20.0%,含N为23.74%,A、B、C式量均不超过500,且其中N-H键键长与氨分子键长接近。
(1)通过计算,推测C的化学式[CoBr(x)(NH(y))(z)]Cl(k)中x、y、z、k值。x=_____________ y=______________ z=______________ k=_________
(2)B、C的颜色接近,鉴别B、C两物质所用的试剂是____________________。
(3)写出制备A的化学方程式。
_____________________________________________________________________;
_____________________________________________________________________。
19.I(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲除可以通过观察反应完成的先后外,还可以通过观察反应_____________________________,定性比较得出结论。有同学提出将FeCl3改为另外一种试剂[备选试剂有:Fe2(SO4)3、FeSO4、Fe(NO3) 3]更为合理,其中可选的试剂是__________________;其理由是_______________。写出H2O2在二氧化锰作用下发生反应的化学方程式________________________________。
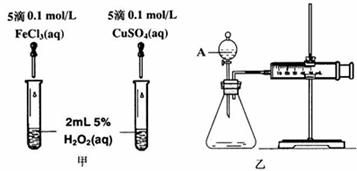
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为___________ __,检查该装置气密性的方法是_______________________________________________。
实验中需要测量的数据是___________________(填“压强”、
“时间”或“温度”)。
Ⅱ(3分)利用实验室所制晶体配制100mL 0.4mol·L-1 CuSO4溶液:
(1)应用托盘天平准确称取CuSO4·5H2O晶体________g。
(2)若晶体已部分风化(失去部分晶体水),则所配制的溶液浓度
将__________(填“偏大”、“偏小”或“无影响”)
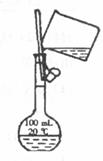
(3)下图是某同学转移溶液的示意图,指出图中的操作错误: _________________。
18.(8分)分析以下材料回答问题。
材料(1) 常见的温室气体表
|
温室气体 |
现有浓度 |
估计平均年增长率(%) |
|
二氧化碳(CO2) |
245g/t |
0.4 |
|
甲烷(CH4) |
1.65g/t |
1-2 |
|
一氧化二氮(N2O) |
0.3g/t |
0.2-0.3 |
|
弗里昂(CFCl11、CFCl12) |
0.2mg/t 0.35mg/t |
5.0 |
|
臭氧层臭氧(O3) |
0.1-10g/t(随高度变化) |
-0.5 |
材料(2)O2、H2、NO未被列入温室气体
由此可见:
(1)温室气体分子组成的共同特点是__________________________________。
(2)以上温室效应气体中起主要作用的是______________________(填化学式)。
(3)在H2O(g)、N2、SO2、CO、NH3中属于温室气体的是_____________________。
(4)写出温室气体CO2的电子式______________________________。
17.(11分)周期表中有3种原子序数依次递增的金属A、B和C,它们均可形成稳定程度不同的二阶离子,C的二价离子比相应A的二价离子多2个电子,C的三价离子可以用KSCN溶液检验,C的单质及其化合物在生产、生活、科技中应用及其广泛。在强碱性介质中形成带色的稳定的含氧酸根MOn2-,三种金属均有高氧化态。
回答问题:
(1)元素A、B和C分别是_______, __________ , ____________。
(2)MOn2-氧化性增强顺序是________________________________________。
(3)BOn2-中的 n=__________;用化学方程式表示B的最高氧化态含氧酸根(BxOyp-)的钾盐与浓盐酸的反应。____________________________________________。
(4)写出C的二价离子在空气中与强碱溶液反应的离子方程式 。
16.(12分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸供热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
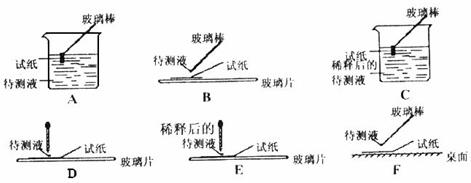
(1)在实验①中,下图所示的操作中正确的是__________________________(填代号)
(2)根据上述实验判断原溶液中肯定存在的离子是___________,不能确定是否存在的离子是__________________。需进一步检验来确定是否存在这些离子,则检验其中的阳离子的实验方法是_________________________。
(3)实验与②是为了确定_____________离子是否存在而进行的,把稀硫酸改用稀盐酸______________(填“是”或“否”)可行。
(4)写出与③、④两个实验有关的离子方程式:
③________________________________________;
④________________________________________。
15.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=== 2As+ 3SnCl62-+6M。 关于该反应的说法中正确的组合是 ( )
①氧化剂是H3AsO3;
②还原性:Cl->As
③每生成7.5gAs,还原剂失去的电子为0.3mol;
④M为OH-;
⑤SnCl62-是氧化产物
A.只有①③⑤ B.只有①②④⑤ C.只有①②③④ D.只有①③
|
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 F-19 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Ca-40 Fe-56 Co-59 Cu-64 Zn-65 Br-80 Ag-108
14. 在一个密闭、恒容的容器中进行下列反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在一定条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是
在一个密闭、恒容的容器中进行下列反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在一定条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是
A.容器内压强增大 B.原平衡不受影响
C.正反应速率增大 D.NO浓度降低
13.pH=l的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是 ( )
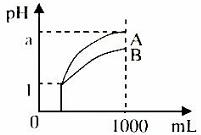
①若a>4,则A、B 都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.① B.③
C.①③ D.②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com