
6.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是
A.硫铁矿燃烧前需要将矿粒粉碎,因为大块的硫铁矿不能燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓H2SO4吸收SO3,能防止形成酸雾、提高吸收效率
29.(14分)
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
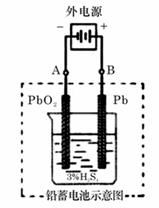
Pb+PbO2+4H++2SO42-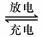 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1) 放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2) 在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成_______、B电极上生成______,此时铅蓄电池的正负极的极性将______________。
27. (14分)下图是用明矾[KAl(SO4)2·12H2O]为主要原料制取Al2(SO4)3和K2SO4的操作步骤流程图(图中略去了沉淀物的洗涤操作)
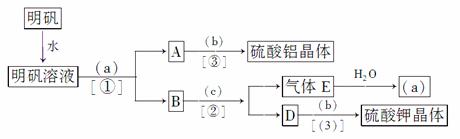
分析图中圆括号内应填入何种试剂,使用何种分离方法,并回答下列问题。
(1)试剂a是__________,b是__________,c是__________,
分离方法①是__________,②是__________,③是__________。
(2)用离子反应方程式表示下列转化过程:
明矾溶液+a A+B:______________________________,
A+B:______________________________,
B+C E:___________________________________。
E:___________________________________。
(3)按上述操作不考虑损耗在理论上158 g明矾最多可制得Al2(SO4)3·18H2O ______g,至少可制得K2SO4 __________g。
28(16分) .
(1)25℃,PH=4的盐酸与PH=4的NH4Cl的溶液中,水电离产生的(H+)之比为
(2)PH=4的硫酸溶液由25℃升高到100℃时,PH= ,PH=10的NaOH溶液由25℃升高到100℃时,PH=
(3)25℃,PH=13的强碱与PH=2的强酸溶液混合,PH=12,则强碱与强酸的体积比为
(4)物质的量都是0.1mol的CH3COOH和CH3COONa在常温下配成1L混合溶液其中的c(CH3COO-)>c(Na+),则溶液显 性,c(CH3COO-) + c(CH3COOH) = mol·L-1
13.25 ℃时,水的电离达到平衡:H2O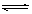 H+ + OH- ;ΔH > 0 ,下列叙述正确的是:
H+ + OH- ;ΔH > 0 ,下列叙述正确的是:
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
第Ⅱ卷(非选择题,共174分)
①A与B能形成多种气态化合物,D与B能形成两种常见气态化合物;
②C和E的原子序数之和等于A和F的原子序数之和;
③E元素的原子半径大于F元素的原子半径。
请回答:
⑴E元素是 (填元素符号)
⑵由B和D形成的两种气态化合物,固态时均属于 晶体;其晶体的粒子之间以 相结合。
⑶由A、C、F三种元素能组成一种离子化合物,该化合物的电子式为 。其水溶液显 (填“酸性”、“中性”或“碱性”),其原因为(用离子方程式表示): 。
⑷具有相同的原子数和相同的电子数的不同粒子称为等电子体。写出由上述各种元素形成的粒子中与C元素的单质互为等电子体的两种粒子的化学式: 和 。
12.从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O====7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.5mol FeS2发生反应,有10mol电子转移
C.产物中的SO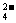 离子有一部分是氧化产物
离子有一部分是氧化产物
D.FeS2只作还原剂
11.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,错误的是:
A. 钢铁腐蚀时可能发生的正极反应:2H2O+ O2+ 4e-=4OH一
B. 明矾水解的离子方程式: Al3++3 H2O Al(OH)3+3H+
Al(OH)3+3H+
C.少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2+ +2OH-+ 2HCO3一= Ca CO3↓+ 2H2O+ CO32-
D. 表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ·mol-1
10.盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是:
A.正极附近的SO42-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸
9. 在一定温度下,一定体积的密闭容器中如下平衡:H2(g)+ I2(g)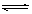 2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.20mol·L-1时,则平衡时H2的浓度(mol·L-1)是:
2HI(g)。已知H2和I2的起始浓度均为0.10mol·L-1,达平衡时HI的浓度为0.16mol·L-1。若H2和I2的起始浓度均变为0.20mol·L-1时,则平衡时H2的浓度(mol·L-1)是:
A.0.16 B.0.08 C.0.04 D.0.02
8.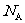 表示阿伏加德罗常数,下列叙述中正确的是:
表示阿伏加德罗常数,下列叙述中正确的是:
A.通常状态下,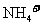 和
和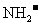 各1 mol含有的电子数均为
各1 mol含有的电子数均为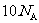
B.标准状况下当氧气与氦气的原子数均为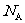 时,它们具有相同的体积
时,它们具有相同的体积
C.2.4g金属镁与足量的盐酸反应,转移电子数为2 NA
D.l mol CH3+(碳正离子)中含有电子数为10 NA
7.主链含5个碳原子,有甲基、乙基2个支链的烷烃有:
A.2种 B.3种 C.4种 D.5种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com