
29.(14分)过氧乙酸(C2H4O3)是一种消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
 ① 2MnO4-+5H2O2+6H+
2Mn2++5O2十8H2O
① 2MnO4-+5H2O2+6H+
2Mn2++5O2十8H2O
 ② H2O2+2
② H2O2+2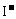 +2H+
I2+2H2O
+2H+
I2+2H2O
 ③ C2H4O3+2
③ C2H4O3+2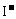 +2H+ CH3COOH+I2+H2O
+2H+ CH3COOH+I2+H2O
 ④ 2 S2O32-+I2 S4O62-+2I-
④ 2 S2O32-+I2 S4O62-+2I-
取20mL待测液,用硫酸使溶液酸化,再用浓度为1mol·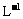 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为20mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为20mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取20 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为3 mol·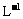 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为60mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为60mL。
(1)已知过氧乙酸分子部分含有与H2O2相同的“结构”,则其结构简式为 。
(2)用KMnO4滴定H2O2中,滴定终点的颜色变化是______________________
(3)当加入的KI的质量 (填写选择序号)时,可不影响测定过氧乙酸的浓度
c0。(多选或少选均不给分)
A.少量需要准确称量 B.少量不需要准确称量
C. 过量需要准确称量 D. 过量不需要准确称量
(4)根据上述实验数据,计算过氧乙酸物质的量浓度(写出主要步骤)
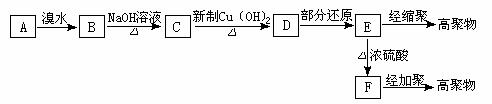
28、(15 分)茚是一种碳氢化合物,其结构为: 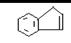 茚有一种同分异构体A,A分子中含有一个苯环,且苯环上只有一个侧链,侧链中有一个碳碳不饱和键。A能发生如下变化:
茚有一种同分异构体A,A分子中含有一个苯环,且苯环上只有一个侧链,侧链中有一个碳碳不饱和键。A能发生如下变化:
已知: 多个羟基连在同一个碳原子上不稳定,易自动失水:
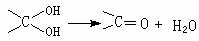
若B、C、D、E分子中均有一个苯环,根据变化关系图和已知条件,请回答
⑴ A的结构简式是 B的结构简式是
⑵ 写出下列反应的化学方程式
① E经缩聚生成高聚物
② F经加聚生成高聚物
⑶ E→F的有机反应类型是 反应。
27.(15分)下列A-L 11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1 mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答:

(1) 写出有关物质的化学式:A__________、I____________。
(2) 写出反应①中化学方程式_____________________________________________。
(3)写出反应②中化学方程式_____________________________________________。
(4) 写出反应③中的离子方程式 _____________________________________ 。
13.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2 + 7O2
 2MoO3 + 4SO2;②MoO3 + 2NH3·H2O = (NH4)2MoO4
+ H2O;
2MoO3 + 4SO2;②MoO3 + 2NH3·H2O = (NH4)2MoO4
+ H2O;
③(NH4)2MoO4
+ 2HCl = H2MoO4↓+ 2NH4Cl; ④H2MoO4  MoO3 + H2O;
MoO3 + H2O;
⑤ 用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
第二卷(非选择题 共174分)
26 (16 分)已知:碱金属或碱土金属(ⅡA)与H2在隔绝空气加热时可以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备纯净CaH2的实验,装置如图所示(分别以序号I、II表示),铁架台等夹持固定仪器已略去(H2的稳定性强于HCl)。
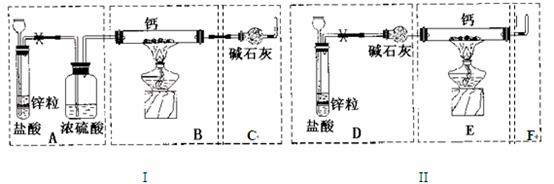
请回答下列问题
(1)锌与盐酸反应的离子方程式为 ;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置I的不足之处是 ,
装置II的不足之处是 ;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示) ;
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先 ,然后再 ,才能点燃酒精灯加热。
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为 ,该反应中的氧化剂是_______。
12.己烯雌酚是一种激素类药物,结构如下,下列有关叙述中正确的是
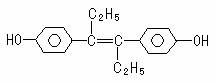
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.1mol该有机物可以与5mol Br2发生反应
C.可与NaOH和NaHCO3发生反应
D.该有机物分子中,所有碳原子都不可能共平面
11.下列除杂或分离方法不正确的是
A.除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯
B.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层
C.除去CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶
D.提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离
10.下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
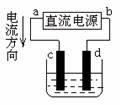
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
9.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有氢气生成,下列叙述正确的是
A. NH4H是离子化合物
B. NH4H溶于水所形成的溶液显酸性
C. NH4H与水反应时,NH4H是氧化剂
D. NH4H固体投入足量水中,只有1种气体生成
8.下列反应的离子方程式正确的是
A. 醋酸铵溶液和盐酸反应:CH3COONH4+H+=CH3COOH+NH4+
B. 硫化钠水解:S2-+2H2O H2S+2OH-
H2S+2OH-
C. 向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3
D. 向稀氨水中加入稀盐酸:NH3.H2O+H+=NH4++H2O
7. 在一容积可变的密闭容器中,通入1mol X和3 mol Y,在一定条件下发生如下反应 X (g) + 3 Y (g) 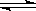 2 Z (g),到达平衡后, Y的体积分数为a %, 然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的体积分数为b %。 则a与b的关系是
2 Z (g),到达平衡后, Y的体积分数为a %, 然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的体积分数为b %。 则a与b的关系是
A. a = b B. a > b C.a < b D.不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com