
1.居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料释放出的一种刺激性气味的气体,该气体是 ( )
A.CH4 B.NH3 C.HCHO D.SO2
30.(10分)某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:
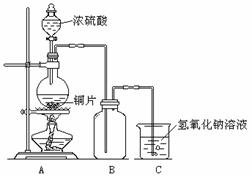
请回答下列问题:
(1)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是_______(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
②实验中若有m g铜参加了反应,则有______mol硫酸被还原。
(2)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案1:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案2:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
方案3:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况)。
实际上,以上方案1、2均不可取,请你说出原因?
方案1: 。方案2: 。
方案3:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL) ___________________ _。
29. (12分)含镁3%-5%的铝镁合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案。
(12分)含镁3%-5%的铝镁合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案。
实验设计1:铝镁合金 测定生成气体的体积(标准状况)
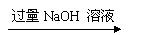

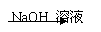 实验设计2:铝镁合金
测定生成气体的体积(标准状况)
实验设计2:铝镁合金
测定生成气体的体积(标准状况)
实验设计3:镁铝合金 溶液 过滤,测定沉淀的质量
回答下列问题:
(1)写出实验设计2方案中有关化学反应方程式
(2)若按实验设计3进行实验,实验过程需要的主要仪器有 (写出3种仪器名称)。将m g镁铝合金,溶于过量盐酸中,再加入过量的NaOH溶液,可得到白色沉淀,该沉淀物质是 (填分子式);将此沉淀洗净、干燥后,称得质量为w g。求合金中镁的质量分数 ;
(3)下列各实验方案中,能测出合金中镁的质量分数的是 。
A.实验设计1 B.实验设计2 C.实验设计3 D.都可以
附加题 (说明:正卷成绩在85分以上,附加题得分计入总分)
28.(12分)已知A、B为气体单质,其中A为黄绿色气体,B为无色气体; C为化合物,其水溶液的pH小于7;D为金属单质,它们之间有下列转化关系:
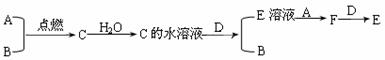
(1)试写出A、B、C、D的化学式:
A_________;B_________;C___________;D_________。
(2)写出C的水溶液与D反应的离子方程式:______________ ;
F+D反应的离子方程式:___________________________ 。
27.(12分)有一已磨成粉末的混合物试样, 是由下列六种物质中的若干种等量组成:
(A) NaCl (B) KCl (C) CaCl2 (D) CuSO4( 无水)
(E) Na2SO4 (F) Na2CO3 为了要确定该粉末试样的成分,某研究性学习小组先查了资料后, 研拟了一个检验粉末试样的流程图, 并在老师的指导下在化学实验室中进行实验。以下是该小组实验报告的一部分:
实验一:用烧杯取粉末试样约2克,加蒸馏水约100毫升,搅拌后形成无色的透明溶液X。
实验二:在溶液X中加了盐酸,观察到在溶液中陆续产生气泡,至溶液不再冒气泡,溶液仍为无色透明(贴上卷标Y)。
实验三:在无色透明的溶液Y中,滴加BaCl2溶液,即见白色沉淀。
实验四:继续滴加BaCl2溶液,至白色沉淀不再产生后,过滤分离出白色沉淀,得到透明的无色滤液Z。
实验五:在滤液Z中,滴入AgNO3溶液,则见白色沉淀,加入稀硝酸,沉淀不溶解。
(1)根据上述实验报告,原粉末中一定没有哪两种物质﹖
(从(A) -(F)中选两项)
(2)原粉末中,一定含有哪两种物质 ﹖ ( 从(A) -(F)中选两项)
(3)若只需回答上述(1)(2)的问题,你认为该小组同学不需要做哪两个实验 (A) 实验一 (B) 实验二 (C) 实验三 (D) 实验四 (E) 实验五
26.(14分)
(1)汽车尾气产生的NO2、 CO等大气污染物,可以在催化剂的作用下转化为无毒物。其反应式可表示为:2NO2 +4CO === N2 +4CO2 。
①标出上述反应电子转移的方向和数目:
②该反应中氧化剂是________,还原剂是________,每有28g N2生成,反应中转移的电子为_____ mol。
(2)“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。若以铜为原料制取硫酸铜或硝酸铜,下列设计你认为符合“绿色化学”思想的反应路线(用化学方程式表示)是 (填写标号)。
A.制CuSO4:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
B.制CuSO4:2Cu + O2 = 2CuO; CuO + H2SO4(稀) = CuSO4 + H2O
C.制Cu(NO3)2:Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O
D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O
(3)已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:
5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4
用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
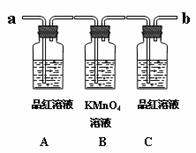
①实验时,反应产生的气体应从 端通入; 从 端连接盛有澄清石灰水的实验装置(用 “a”或“b” 填空)。
②可观察到A瓶的溶液 。
③B瓶溶液的作用是 。
25.在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L,c(Cl-)=0.2mol/L,则c(NO3-)为 ( )
A.0.15 mol/L B.0.20 mol/L C.0.25 mol/L D.0.40 mol/L
|
24.下列关于浓硫酸的叙述中,正确的是 ( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
23.只用一种试剂,可区别Na2SO4、AlCl3、NH4Cl、MgSO4四种溶液,这种试剂是( )
A.HCl B.BaCl2 C.AgNO3 D.NaOH
22.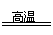 制备粗硅的反应为:SiO2+2C
Si+2CO↑,其中氧化剂与还原剂的物质的量之比为 ( )
制备粗硅的反应为:SiO2+2C
Si+2CO↑,其中氧化剂与还原剂的物质的量之比为 ( )
A.1 : 3 B.3 : 1 C.1 : 2 D.2 : 1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com