
11.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.1L0.1mol/L的Na2CO3溶液中,含Na+ 0.2NA个,CO32- 0.1NA个
B.2L0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4NA个
C.1L0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9NA个
D.0.1mol/L的H3PO4溶液中,c(H+)∶c(PO43-)<3∶1
10.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-一定存在 D.Ba2+一定不存在,Mg2+可能大量存在
9.在0.1
mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+
CH3COO-+H+
对于该平衡,下列叙述正确的是 ( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
8.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是 ( )
A.0.1mol/L盐酸和0.1mol/L氢氧化钠溶液
B.0.1mol/L硫酸和0.1mol/L氢氧化钠溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠
D.pH=4的盐酸和pH=l0的氨水
7.请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是 ( )
A.几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B.用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C.一定条件下,金属钠可以成为绝缘体
D.一定条件下,水在20℃时能凝固成固体
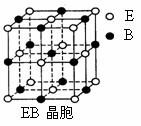
21A.(物质结构与性质)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:

⑴写出F的基态原子核外电子排布式:__________________。
⑵C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是_________
___________________________________。
⑶由A、B、D三种元素形成的一种物质俗称光气,分子中A
原子采取sp2杂化成键。光气分子的结构式是___________,其中
碳氧原子之间共价键是_____(填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
⑷EB晶胞如下图所示,EB晶体中E2+的配位数为_____,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:
EB-3401kJ/mol、NaCl-786kJ/mol。导致两者晶格能差异的主要原因是______________________________________________。
⑸现有含F的两种颜色的晶体,一种为紫色,另一为绿色,它们都是配位数为6的配合物(配离子难电离)。相关实验证明,两种晶体的组成皆为FD3·6H2O。为测定这两种晶体的化学式,取等质量的两种晶体分别配成待测溶液,各滴入足量的AgNO3(aq),原绿色晶体的水溶液得到白色沉淀的质量为紫色晶体的水溶液得到白色沉淀质量的2/3 。
则紫色晶体配合物的化学式为________________,绿色晶体中含有化学键类型是 。
21B.(实验化学)“百年新药”阿司匹林自问世以来,一直作为解热镇痛药用于头痛、发热、神经痛、风湿热等疾病的治疗,20世纪70年代以后阿司匹林在其它领域的防治功能被逐步开发,如阿司匹林可增进大脑血液循环,对冠心病有预防作用。
药品“阿司匹林泡腾片”说明书上标明:阿司匹林的有效成分是乙酰水杨酸,结构简式为: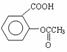 ,每片含乙酰水杨酸0.3g。
,每片含乙酰水杨酸0.3g。
某研究性学习小组看了市售阿司匹林的药品说明书,为了验证乙酰水杨酸的官能团和测定市售阿司匹林的有效成分含量,进行了下列实验探究:
⑴阿司匹林有效成分中羧基和酯基官能团的验证
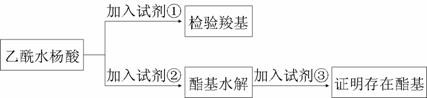
试剂①是________,现象为_________;
该方案通过检验乙酰水杨酸水解生成的____________,并通过分析间接验证酯基的存在。
⑵市售阿司匹林的有效成分含量的测定
用酸碱滴定法测定市售阿司匹林有效成分的真实含量,实验步骤如下:
①取6片市售阿司匹林药片放入锥形瓶中,再加入1.500mol·L-1的氢氧化钠溶液,为确保阿司匹林和氢氧化钠溶液充分反应,加入1.500mol·L-1的氢氧化钠溶液的体积应大于_____mL。
②将反应后的溶液冷却,加入几滴________,用0.5000mol·L-1的标准盐酸滴定过量的氢氧化钠,至____________________________________。
③重复步骤①和步骤②
问题讨论:
为什么不用氢氧化钠溶液直接滴定乙酰水杨酸_________________________________。
为什么要进行两次滴定?___________________________________________。
20.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式。
⑵由气态基态原子形成 1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
已知,CH3-CH3→CH2=CH2+H2;有关化学键的键能如下。 化学键 C-H C=C C-C H-H 键能(kJ/mol) 414.4 615.3 347.4 435.3
试计算该反应的反应热(在答题纸中写出计算过程)。
⑶依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。
 试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变(在答题纸中写出计算过程)。
试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变(在答题纸中写出计算过程)。
 ①CH3COOH(l)+2O2(g) 2CO2(g)+2H2O(l);△H1=-870.3kJ·mol-1
①CH3COOH(l)+2O2(g) 2CO2(g)+2H2O(l);△H1=-870.3kJ·mol-1
 ②C(s)+O2(g) CO2(g);△H2=-393.5kJ·mol-1
②C(s)+O2(g) CO2(g);△H2=-393.5kJ·mol-1
 ③H2(g)+1/2O2(g) H2O(l);△H3=-285.8kJ·mol-1
③H2(g)+1/2O2(g) H2O(l);△H3=-285.8kJ·mol-1
19.对羟基苯甲醛是一种合成医药、香料、液晶材料的重要中间体,以对甲基苯酚为主要
原料 合成对羟基苯甲醛
合成对羟基苯甲醛 的工艺流程如图所示。
的工艺流程如图所示。
(已知对羟基苯甲醛的熔点≥115.5℃,在水中的溶解度为1.38g)
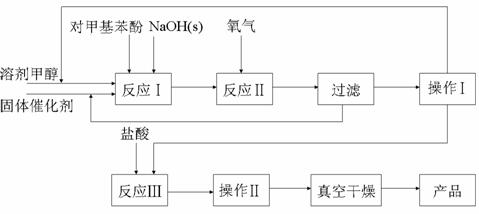
⑴写出反应Ⅱ化学方程式____________________________________________________,
在生产中不直接用氧气氧化对甲基苯酚的原因是____________________________。
⑵写出对羟基苯甲醛在一定条件下与足量氢气反应的化学方程式___________________。
⑶用核磁共振氢谱对产品进行纯度分析,发现核磁共振氢谱上有四个吸收峰,由此可判断产品_______(填纯净或混有杂质)
⑷对羟基苯甲醛有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式为______________________________________________。
⑸在工艺流程中“操作Ⅰ”的方法是_____________,“操作Ⅱ”的方法是_____________,“真空干燥”的主要目的是________________________。
18.硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:
⑴向大气中排放NOx可能导致的环境问题有 。(答两点)已知足量NaOH溶液能完全吸收NO2生成氮的含氧酸盐,试写出该反应的离子方程式
。
⑵光导纤维的使用,让人们的生活更加丰富精彩, 是制备光导纤维的基本原料。
⑶氮化硅陶瓷是一种新型无机非金属材料,其化学式为 ,可由硅粉(用Al2O3和Y2O3作助剂)在氮气中高温烧结而成,氮气在反应中既是反应物,同时又起了_____________作用。由于使用的硅粉表面含二氧化硅,在反应中需加入碳粉。在烧结过程中,二氧化硅、碳、氮气以物质的量之比3:6:2反应生成两种化合物,该反应的化学方程式为 。
⑷硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源。与“氢能源”比较“硅能源”具有________________________________等更加优越的特点,从而得到全球的关注和期待。
17.铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②高温灼烧CuO生成Cu2O;③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+=Cu+Cu2++H2O。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
⑴请你评价方案1和方案2。如果你认为方案合理,请简述其化学原理;如果你认为该方案不合理,请简述原因。
方案1 :
方案2 :
⑵方案3中,若确认红色粉末中含有Cu2O,则a、b、c应符合的数学的关系为 ,该实验方案最少得进行 次称量。
Ⅲ.研究性学习小组乙,设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示。
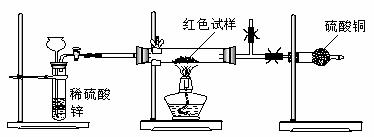
⑶简述该探究方案中,检验气体发生装置气密性的方法(说明操作方法、现象和结论)
。
⑷为确保探究的科学、合理、安全,你认为实验中还应采取的措施有: (填序号)
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com