
4.英国研究人员 2007 年 8 月 30 日发表报告认为,全球将有 1.4 亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡 24 小时后,其含砷量才能达到食用安全标准。下列对砷(As)的有关判断正确的是 ( )
A.砷原子序数为33,它与铝为同主族 B.砷的原子半径小于磷的原子半径
C.砷化氢的稳定性比溴化氢的强 D.砷酸的酸性比硫酸的弱
3.设NA表示阿伏加德罗常数,下列叙述中不正确的是 ( )
A.31g仅含有少量白磷,无其他杂质的红磷样品中,共含有NA个磷原子
B.假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C.1mol Na2O2与水反应转移的电子数为NA
D.标准状况下,3.36L乙烷中含有的共价键数约为1.05NA
2.下列各组物质,可用一种试剂进行鉴别的是 ( )
①五种黑色固体:FeO、Fe、CuO、C、MnO2 ;
②四种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4、NaCl ;
③三种有机物:苯、四氯化碳、无水乙醇
A.只有①② B.只有①③ C.只有②③ D.全部
1.背景材料:①2006年5月信息时报报道:世界卫生组织建议每天钠的摄取量少于2000mg,长期过量摄入钠可能引起高血压、肾病、胃病;②2007年7月,广西加大人工降雨作业强度,使夏季旱情得以缓解;③空气是人类生存所必需的重要资源。改善空气质量称为“蓝天工程”;④2008年夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念。下列相应说法不正确的是 ( )
A.钠是活泼金属,常常保存在煤油中,人们每天可摄取少于2000mg的金属钠
B.AgI和干冰都可用于人工降雨
C.加大石油、煤炭的开采速度,增加化石燃料的供应量不利于“蓝天工程” 的建设
D.把环境保护作为奥运设施规划和建设的首要条件之一
31.化学选考题(15分)(以下三题[A、B、C]任选一题,若三题都答按前面一题计分)
A.[化学--选修化学与技术]
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:
。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
|
温度(℃) |
0 |
20 |
60 |
|
K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
A.熔点较低(29℃熔化) B.能导电 C.能制冷 D.无毒
(7)上述工艺流程中体现绿色化学理念的是: (3分)。
B.[化学选修--物质结构与性质]
(每空2分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
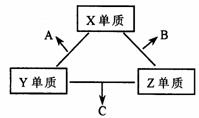
(1)X元素在周期表中的位置是 周期 族。(各1分)
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在 。
(3)①C的电子式是 ,C分子的结构呈 形。
②C在一定条件下反应生成A的化学方程式是 。
③X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(1分)(填“大于”、“小于”、“等于”),其原因是(写出离子方程式) 。
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,C的体积分数增大
C.[化学选修--有机化学]
(每空2分)乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃-80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
|
物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
|
沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |
请回答下列问题:
(1)试管A内在60℃-80℃时发生的主要反应的化学方程式(注明反应条件)___;(3分)
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____;当试管A内的主要反应完成后温度计水银球的位置应在_______,目的是___________。


(3)烧杯B的作用是__________;烧杯B内盛装的液体可以是__________(写出一种即可);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为_____________________________。
30.(13分)一定条件下,在体积为3
L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)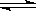 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= (3分),升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
A.氢气的浓度减少 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
29.(16分 每空2分)下图所示是进行木炭与浓硝酸反应,并检验生成的气体和反应的热效应的实验装置,它具有无污染,现象明显的特点。具支试管A中所盛固体下层是无水CaCl2(做载体不参加反应),上层是红热的木炭。实验时慢慢将浓硝酸滴到木炭上,反应即开始进行且能长时间剧烈反应。
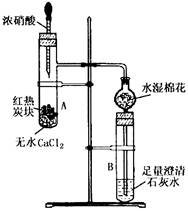
请回答下列问题:
(1)写出木炭与浓硝酸反应的化学方程式
______________________________________(3分)
(2)该反应的反应热△H________O(填“>”或“<”),这一结论的实验证据是_________________;
(3)实验中具支试管A内出现的现象是_________________________________________
(4)试管B内出现的现象为_________________________________________,
澄清石灰水中发生主要反应的离子方程式为_________________________;(3分)
(5)某学生在实验临近结束时,发现滴管中的浓硝酸难以滴下。若要再滴入几滴浓硝酸使木炭反应完全,最简单的办法是______________________ ____。
28.(14分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。(4分)
13.下列实验操作正确的是: ( )
A.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中液面
B.分液时分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.容量瓶检漏的操作:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水
D.观察钾元素焰色反应:将铂丝放在稀盐酸中洗涤,然后蘸取固体碳酸钾,置于酒精灯的火焰上进行灼热,透过蓝色钴玻璃进行观察
12.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.向碳酸氢镁溶液中加人过量氢氧化钠 Mg2++HCO3-+OH-=MgCO3↓+H2O
B.硫氢化钠的水解:HS-+H2O H3O++S2-
H3O++S2-
C.少量氢氧化钙溶液与碳酸氢钙溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.表示氢气燃烧热的热化学方程式:2 H2(g)+ O2(g)=2 H2O(g);ΔH = -571KJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com