
3.含有极性共价键的原子晶体是 ( )
A.食盐 B.干冰 C.水晶 D.晶体硅
2.在下列工业生产中,进行的主要反应不属于氧化还原反应的是 ( )
A.电解法冶炼铝 B.由石灰石、石英、纯碱制玻璃
C.接触法制硫酸 D.由焦炭、水、空气等合成氨
1.下列叙述中不正确的是 ( )
A.金刚石和石墨互为同素异形体
B.H2和D2互为同位素
C.油酸和丙烯酸(CH2=CHCOOH)互为同系物
D.丙酸和甲酸乙酯为同分异构体
30.某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
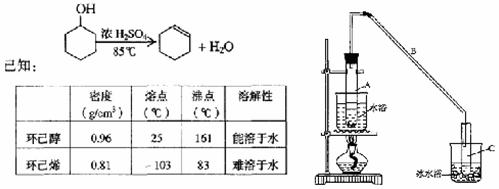
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是____________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰, 目的是__________________。
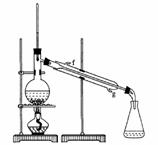
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
29.反应A+B 2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,温度(T)之间的关系如图所示(B、C均为无色物质):
2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,温度(T)之间的关系如图所示(B、C均为无色物质):
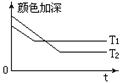
(1)该反应是_______热反应;
(2)若A、B、C均为气态物质,增大压强,B的转化率________,混合气体的颜色______
(3)若A、B为气态物质,C为固态,增大压强,A的转化率__________。
28.影响化学反应速率的外部因素主要有 、 、 和催化剂等。已知某反应在催化剂作用下按以下两步进行:第一步 X+Y == Z 第二步 Y+Z== M+N+X
(1)此反应的总反应式为 ____________________
(2)反应的中间产物是
(3)反应的催化剂是
27.实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出甲烷,石墨,氢气燃烧反应的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
C(石墨)+ O2(g) = CO2(g) ΔH2= -393.5kJ/mol
H2(g)+1/2O2(g) = H2O (l) △H3= -285.8KJ/moL ,则由石墨生成甲烷的反应热:
C(石墨)+ 2H2(g)= CH4(g) ΔH4=
26.0.3moL气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5KJ热量,请写出乙硼烷燃烧的热化学方程式
又已知:H2O(l)→H2O(g) ;△H=+44KJ/moL,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 。
25.在4L的容器中加入6molA和5molB,在一定条件下发生下列反应3A(气)+B(气) 2C(气)+xD(气)5分钟达到化学平衡,此时C为2mol,测得D的平均化学反应速率为0.1mol/(L·min),下列说法正确的是 ( )
2C(气)+xD(气)5分钟达到化学平衡,此时C为2mol,测得D的平均化学反应速率为0.1mol/(L·min),下列说法正确的是 ( )
A.A的平均化学反应速率为0.15mol/(L·min)
B.恒温下达化学平衡时,容器内压强是开始时的85%
C.B的转化率为30%
D.平衡时A的浓度为0.8mol/L
|
24. 两体积相同的密闭容器中均充入1 mol X和1mol
Y,分别在300℃和500℃下发生如下反应:X(g)+Y(g) 3Z(g),得到Z的含量随时间t变化的a,b两条曲线(如图所示)。已知在t3时刻改变了某一实验条件,相关判断正确的是
( )
两体积相同的密闭容器中均充入1 mol X和1mol
Y,分别在300℃和500℃下发生如下反应:X(g)+Y(g) 3Z(g),得到Z的含量随时间t变化的a,b两条曲线(如图所示)。已知在t3时刻改变了某一实验条件,相关判断正确的是
( )
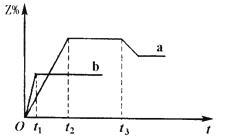
A.曲线a是500℃时的图像
B.正反应是吸热反应
C.t3时刻可能是增大了压强
D.t3时刻可能是降低了温度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com