
24.(12分)有三种常见短周期元素A、B、C,它们的原子序数依次增大。A元素原子最外层电子数比B元素原子最外层电子数多1个,B元素原子最外层电子数是C元素原子最外层电子数的一半。甲是B元素含氧酸的钠盐;乙是C元素最高价含氧酸的酸式钠盐;丙是A元素含氧酸的钠盐(正盐)。甲、丙溶液pH>7,乙溶液pH<7。丁为无色、无味的气体,戊为淡黄色固体,丁与戊的反应是呼吸面具中发生的主要反应。甲、乙、丙、丁、戊、己六种物质之间相互反应关系如下(与变化无关的产物已略去):
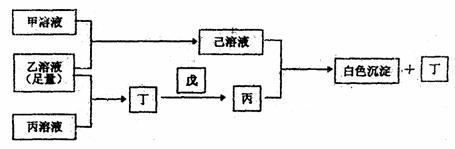
试回答:
(1)C元素的名称为 ;
丁的结构式为 ;
戊的电子式为 。
(2)用电离方程式解释:
乙溶液显酸性的原因是:
(3)写出有关反应的离子方程式:
①B单质+NaOH溶液:
②乙溶液+丙溶液→白色沉淀+丁: 。
23.(8分)将1molBr2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:
 Br2(g)+H2(g) 2HBr(g);△H<0。30s后达到平衡,其中HBr的体积分数φ(HBr)随时间变化如下图曲线(II)所示
Br2(g)+H2(g) 2HBr(g);△H<0。30s后达到平衡,其中HBr的体积分数φ(HBr)随时间变化如下图曲线(II)所示
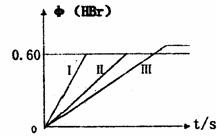
(1)达平衡时,用Br2(g)表示的化学反应速率是 。
(2)若改变反应条件,在甲条件下φ(HBr)的变化如图中曲线(I)所示,在乙条件下φ(HBr)的变化如图中曲线(III)所示,则甲条件可能是(填入下列条件的序号,下同) ,乙条件可能是 。
A.恒温条件下,缩小反应容器体积
B.恒温条件下,扩大反应容器体积
C.恒容条件下,升高温度
D.恒容条件下,降低温度
E.恒温、恒容条件下,加入适当催化剂
F.恒温、恒容时充入氩气
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol Br2(g),b mol H2(g)和c mol HBr(g),发生反应,达到平衡时,HBr的体积分数仍为0.60,则a,b,c的关系是:c= (用含有a和b的代数式表示。)
22.(14分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示的装置进行有关的实验。

请回答:
(1)装置A中发生反应的化学方程式为 。
(2)装置D中试管中放置的棉花中应浸一种液体,这种液体是 ,其作用是 。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。B中应放置的液体是 (填选项序号)
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,他们取6.4g铜片和10mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能与铜片完全反应,你认为原因是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是 (填选项序号)
a.Fe粉 b.BaCl2溶液 c.Ag粉 d.NaHCO3溶液
(5)为定量测定余酸的物质的量浓度,某同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。而测定SO2的量的方法有多种,你认为下列实验方案中可行的是 (填选项序号)
a.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置A产生的气体缓缓通入足量的用硫酸酸化的KMnO4溶液,再加入BaCl2溶液,过滤、洗涤、干燥、称量沉淀
c.用排水法测定装置A产生气体的体积(已折算成标准状况)
d.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
21.(6分)下列有关实验操作不合理的是 (填序号)。
A.氯水或浓硝酸应存在配有磨口玻璃塞的棕色试剂瓶中
B.碱式滴定管中装满标准NaOH溶液后,尖嘴部分若有气泡,赶走气泡的方法是:用手将下端胶管弯曲,使尖嘴部分向上倾斜,然后挤压玻璃珠,快速放液至赶走气泡为止
C.用pH试纸检测溶液的酸性的操作是:先取一条试纸放在表面皿上,用干燥洁净的玻璃棒蘸取待测液点在试纸的中部,30s内观察颜色的变化并与标准化色卡比较,确定溶液的pH
D.用25mL量筒取3.0mL浓硫酸
E.液态氯乙烷试样加入稀NaOH溶液煮沸,然后再加入硝酸银溶液检验氯元素
F.在2mL10%NaOH溶液中滴加2% CuSO4溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有红色沉淀生成
20.烃分子中若含有双键,三键或环,其碳原子所结合的氢原子则少于同碳原子数对应烷烃所含的氢原子数,亦具有一定的不饱和度(用Ω表示)。下表列出几种烃的不饱和度:
|
有机物 |
乙烯 |
乙炔 |
环已烷 |
苯 |
|
Ω |
1 |
2 |
1 |
4 |
据此下列说法不正确的是 ( )
A.1molΩ=3的不饱和链烃再结合6molH,即达到饱和
B. 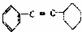 的Ω=7
的Ω=7
 C.C4H8的不饱和度与C3H6、C2H4的不饱和度不一定相同
C.C4H8的不饱和度与C3H6、C2H4的不饱和度不一定相同
D.CH3CH2CH ===CH2与环丁烷( )的不饱和度相同
|
19.下列为元素周期表前四周期的一部分,下列有关表中各元素的叙述正确的是 ( )
|
|
|
|||
|
|
② |
④ |
|
|
|
① |
③ |
⑤ |
⑥ |
|
|
|
|
|
⑦ |
|
A.原子半径的大小顺序是:①>②>③>④
B.氢化物的沸点:⑤高于④
C.最高价氧化物对应水化物的酸性:②比③强
D.氢化物的稳定性:⑦比⑥强
18.物质的量浓度均为0.1 mol·L-1的弱酸HA和NaA溶液等体积混合后,溶液中微粒浓度关系错误的是 ( )
A.c(Na+) + c(H+) === c(A-) + c(OH-)
B.c(A-) + c(HA) === 2c(Na+)
C.若混合液呈酸性,则c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
D.若混合液呈碱性,则c(Na+)>c(HA) > c(A-) >c(OH-) >c(H+)
17.将一直流电源的正、负极(电极材料为Pt),用玻璃片分别压在一张用食盐水、碘化钾、淀粉溶液和石蕊试液浸透的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是 ( )
|
|
A |
B |
C |
D |
|
阳极 |
蓝 |
白 |
红 |
蓝 |
|
阴极 |
白 |
蓝 |
蓝 |
蓝 |
16.总反应离子方程为2Fe3++Fe = 3Fe2+的原电池,下列叙述正确的是 ( )
A.正极发生氧化反应
B.负极反应式为:Fe-3e-=Fe3+
C.能实现该反应的原电池是:正极为Cu,负极为Fe,电解质溶液为Fe2(SO4)3溶液
D.能实现该反应的原电池是:正极为Fe,负极为Zn,电解质溶液为FeCl3溶液
15.下列各组离子能在指定溶液中,大量共存的是 ( )
A.无色溶液中:[Ag(NH3)2]+、K+、H+、NO-3
B.使甲基橙变红的溶液中:Al3+、Cl-、Fe2+、NO-3
C.常温下,pH=12的溶液中:S2O2-3、Cl-、K+、SiO2-3
D.含有较多Fe3+的溶液中:Na+、SO2-4、SCN-、I-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com