
3.下列各组中两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.密度相同、体积不同的CO和C2H4 D.压强相同,体积相同的O2和H2
2.NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.通常状态下,NH4+和NH2-各1 mol含有的电子数均为10NA
B.标准状况下当氧气与氦气的原子数均为NA时,它们具有相同的体积
C.在100 mL 1 mol·L-1乙酸溶液中含乙酸的分子数为0.1 NA
D.1 mol 硫化氢在氧气中完全燃烧时,转移的电子数为2NA
1.下列关于物质的量的叙述中,错误的是 ( )
A.0.012 kg 12C 中含有约6.02×1023个碳原子
B.1 mol SO2在标准状况下的体积约为22.4 L
C.1 mol水中含有2 mol 氢和1 mol 氧
D.1 mol Ne含有约6.02×1024个电子
24.(8分)为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀27.96 g;再另取同样的FeSO4溶液200 mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.00g。
(1)通过计算,填写右表:
|
C(H+) |
C(SO42-) |
C(Fe2+、Fe3+) |
|
|
|
|
(注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的物质的量的浓的总浓度)
(2)计算原溶液中Fe2+被氧化的百分率_______。
(以上两问不用写计算步骤,只写结果)
23.(20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略,A.b是分液漏斗的活塞,c是胶管处),按要求回答问题。
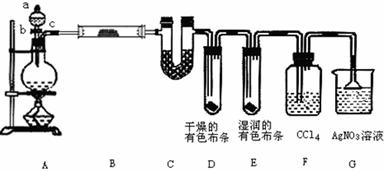
(1)如何检查装置A气密性?_____________________________________________
写出装置A中反应的离子方程式___________________________
(2)①装置B中盛放的试剂名称为 ,装置C的作用是
②装置D和E中出现的不同现象说明的问题是
③装置F的作用是 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 (填写试剂或用品名称)
22.(13分)据报道,ACV浓缩饮料风靡全美,它具有解毒、降脂、减肥和止泻等多种疗效,其中苹果酸M(相对分子质量为134)是主要的活性物质,其化学成分及有关实验如下:
①M分子中含有C 36.0%(质量分数,下同)含H 4.5%,其余为氧元素;
②各取1×10-3mol M与足量NaHCO3反应放出CO2 44.8mL(标准状况,下同),与足量金属钠反应放出H2 33.6mL;
③M分子中所有碳原子在同一条链线上。
回答下列问题:
(1)M的化学式为________________,分子结构中含有的官能团名称是_____________;
(2)已知M有多种同分异构体,试写出其中一种符合下述要求的结构简式:1mol该有机物与足量金属钠反应生成1molH2_______________________________;
(3)为制备M,化学工作者从某气态烃与溴蒸气的取代产物中分离出一种多溴代烃N,经多步反应,最后生成M。
已知 ,
,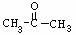 不能被O2氧化,但可以与H2加成,合成路线为:
不能被O2氧化,但可以与H2加成,合成路线为:



 N
有机物A 有机物B
有机物C M,其中B能发生银镜反应。
N
有机物A 有机物B
有机物C M,其中B能发生银镜反应。
①有机物N的结构简式为_____________________________________
②A转化为B的化学方程式为__________________________________________
③有机物C转化为M的反应类型为_____________________________________
21.(9分)禽流感(Bird Flu)是由禽流感病毒引起的一种急性传染病,也能感染人类。由中国科研人员从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有100%的治愈率。根据下面金丝桃素的结构简式回答下列问题:
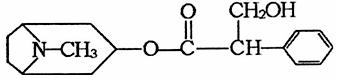
(1)金丝桃素能在NaOH水溶液中加热反应得A和B,B为芳香族化合物,写出B的结构简式:
B. ,该反应属于 反应。
(2)室温下,B用稀盐酸酸化得C,下列物质中不能和C发生反应的是 (填序号)
①浓H2SO4和HNO3的混合液 ②H2(催化剂加热) ③CH3CH2CH2CH3
④Na ⑤O2(催化剂加热) ⑥Na2CO3溶液
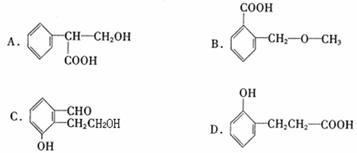
(3)下列物质与C互为同分异构体的有 。
20.有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:
|
① |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr 151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
|
③ |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O 100.0 |
H2S -60.0 |
(d) -42.0 |
H2Te -1.8 |
|
⑤ |
CH4 -161.0 |
SiH4 -112.0 |
GeH4 -90.0 |
(e) -52.0 |
对于表中内容,下列叙述中正确的是 ( )
A.A. B.c的化学式分别为Be、Br2、HF
B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
D.上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
19.我国支持“人文奥运”的一个重要的体现是坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图,有关该物质的说法不正确的是 ( )
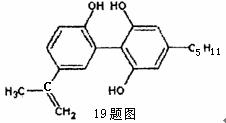
A.滴入酸性KMnO4溶液,紫色褪去,可证明其结构中存在碳碳双键
B.1mol该物质与H2(一定条件下)反应时,最多消耗H2的物质的量为7mol
C.该分子中可与FeCl3溶液反应
D.该物质的所有碳原子不可能共面
18.下列说法正确的是 ( )
A.不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
B.可以用分液漏斗分离下列三组液态混合物:硝基苯和水;油酸和水;三溴苯酚和苯
C.在由水电离出的c(H+)=1×10-14mol·L-1的溶液中可以大量存在Na+、K+、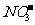 、
、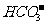
D.实验室可用煤油保存少量钠和钾
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com