
12.在2KI + O3 + H2O=2KOH + O2 + I2的反应中,下列有关叙述不正确的是 ( )
A.反应中H2O做还原剂
B.该反应的电子转移总数为2e-
C.O3 可以使湿润淀粉碘化钾试纸变蓝
D.O2既不是氧化产物,又不是还原产物
11.在室温下,下列pH=3的酸溶液和pH=11的碱溶液等体积混合后,溶液的pH一定小于7的是 ( )
A.硝酸溶液跟氢氧化钾溶液 B.盐酸跟氨水
C.硫酸溶液跟氢氧化钠溶液 D.醋酸溶液跟氢氧化钡溶液
9.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的焓变(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化 学 键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1mol化学键时放出的能量(kJ·mol-1) |
436 |
243 |
431 |
则下列热化学方程式不正确的是 ( )
A. 1/2H2(g)+ 1/2Cl2(g)=HCl(g);△H=-91.5 kJ·mol-1
B. H2(g)+ Cl2(g)=2HCl(g);△H=-183 kJ·mol-1
C. 1/2H2(g)+ 1/2Cl2(g)=HCl(g);△H=+91.5 kJ·mol-1
D.2HCl(g)= H2(g)+ Cl2(g);△H=+183kJ·mol-1
|
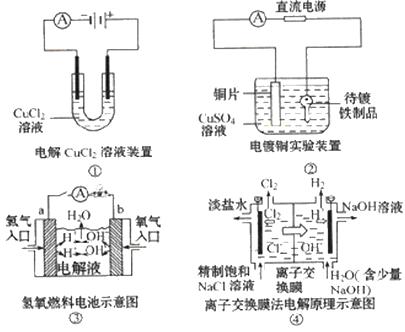
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
8.下列反应的离子方程式正确的是 ( )
A.铝投入氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑
 B.以惰性电极电解硫酸铜溶液:2Cu2++2H2O
2Cu+O2↑+4H+
B.以惰性电极电解硫酸铜溶液:2Cu2++2H2O
2Cu+O2↑+4H+
 C.碳酸氢钠溶液水解:HCO3-+H2O CO32-+H3O+
C.碳酸氢钠溶液水解:HCO3-+H2O CO32-+H3O+
D.漂白粉溶液中通入二氧化碳气体:2ClO-+CO2+H2O=2HClO+CO32-
7.室温下,pH相同、体积相同的醋酸和盐酸分别采取下列措施,有关叙述正确的是( )
A.加入适量醋酸钠晶体后,两溶液的pH均增大
B.将温度升高至50℃,两溶液的pH均不变
C.加水稀释至原体积的2倍后,两溶液的pH均减小
D.加入足量锌粉充分反应后,两溶液产生氢气一样多
6.据报道,美国正在研究的锌电池可能取代目前广泛使用的铅酸蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是 ( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2OH--2e-=ZnO+H2O
C.正极发生氧化反应
D.电解液肯定是强酸
5.一定能在指定环境中大量共存的是 ( )
A.c(H+)=1×10-2mol·L-1的溶液:Na+、NH4+、CO32-、SO42-
B.在由水电离出的c(H+) = 1×10-12mol/L的溶液中:Fe 3+ ClO- Na + SO42-
C.在pH=1的溶液中:NO3- SO42- Na+ Fe 2+
D.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
4.若用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.32g臭氧中,含有氧原子2NA
B.在标准状况下,2.24L苯中所含分子数约为NA
C.9gD2O中含有的电子数为5NA
D.7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA
3.淀粉、蛋白质、脂肪是人体必需的营养物质。根据学过的化学知识下列有关说法合理的是 ( )
A.它们都是天然高分子化合物,一定条件下都能发生水解、氧化反应
B.动植物的油脂中都含有油酸,油酸分子中含有碳碳双键,易被空气中的氧气氧化变质
C.淀粉在人体内水解的最终产物是葡萄糖
D.根据蛋白质的变性原理,硫酸铜可以用作外伤止血剂
2.下列说法正确的是 ( )
A.空气质量日报中二氧化碳的含量属于空气污染指数
B.明矾和漂白粉用于自来水的净化消毒两者原理不同
C.水晶项链和餐桌上的瓷器都是硅酸盐产品
D.粗硅制备单晶硅不涉及氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com