
10.(16分)A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。

回答下列问题:
(1)A的化学式为 ;
(2)分别写出反应①和③的化学反应方程式 ; 。
(3)Z和W在催化剂作用下反应生成C和Y,指出该反应在现代学化学工业上的实际意义 ,该反应的化学方程式为 ;
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为 g。
(5)将Z与N反应后的产物溶于水中,则常温该溶液的pH 7,其原因是(用离子方程式表示) 。
9.(12分)已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下转化关系
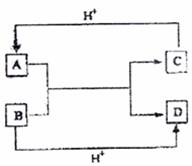
①如果A、B、C、D均是10电子的微粒,请写出:
A的电子式 ;
D的电子式 。
②如果A和C是18电子的微粒,B和D是10电子的微粒,请写出:
(i)A和B在溶液中反应的离子方程式 ;
(ii)根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示): 。
8.常温下,将pH=1的盐酸溶液平均分成两等份,一份加入适量水,另一份加入与该盐酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入的水和氢氧化钠溶液的体积比为 ( )
A.5:1 B.6:1 C.10:1 D.11:1
|
7.某无色气体,可能含有HCl,CO2,NO2,HI,SO2,HBr中的一种或几种。将其通入氯水中,得到无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀,另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是 ( )
A.一定存在HCl B.一定存在SO2
C.肯定没有CO2 D.不能肯定是否含有NO2,HI
6.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。下列的叙术中,正确的是 ( )
A.在该盐要溶液中,[H+]+[H2Y]=[OH-]+[Y2]
B.在该盐的溶液中,离子浓度大小关系为[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
C.在该盐的溶液中,离子浓度之间的关系为[Na+]+[H+]=[HY-]+[OH-]+[Y2-]
 D.HY-的水解方程式为:HY-+H2O H3O++Y2-
D.HY-的水解方程式为:HY-+H2O H3O++Y2-
5.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是 ( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用NaOH溶液洗净后,直接加入一定体积的未知浓度的NaOH溶液
C.滴定时,没有赶净滴定管尖嘴处的气泡
D.读数时,视线与滴定管内液体凹液面最低处保持水平
4.不断升高温度,可实现“雪→水→水蒸气→氧气和氢气”的变化,在变化的各阶段被破坏的粒子间的主要作用力依次是 ( )
A.氢键;分子间作用力;非极性键 B.氢键;氢键;极性键
C.氢键;极性键;极性键 D.分子间作用力;氢键;非极性键
3.下图为某化学反应速率--时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是 ( )

 A.2SO2(g) + O2(g) 2SO3(g);△H<0
A.2SO2(g) + O2(g) 2SO3(g);△H<0
 B.4NH3(g) + O2(g) 4NO(g)+6H2O(g);△H<0
B.4NH3(g) + O2(g) 4NO(g)+6H2O(g);△H<0
 C.H2(g) + I2(g) 2HI(g);△H>0
C.H2(g) + I2(g) 2HI(g);△H>0
 D.C(s) + H2O(g) CO(g)+H2(g);△H>0
D.C(s) + H2O(g) CO(g)+H2(g);△H>0
2.PH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如下图所示,则下列说法正确的是 ( )
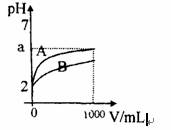
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.A是强酸,B是弱酸
D.若A、B都是弱酸,则2<a<5
1.下列说法正确的是 ( )
A.久置的KI溶液和食盐撒在燃着液化气的火焰上,火焰都呈黄色,都是化学变化
 B.Fe(NO3)2溶液中存在平衡:Fe2+ + 2H2O Fe (OH)2+2H+,加入少量稀盐酸后溶液颜色会变黄
B.Fe(NO3)2溶液中存在平衡:Fe2+ + 2H2O Fe (OH)2+2H+,加入少量稀盐酸后溶液颜色会变黄
C.SO2有漂白性,将SO2通入石蕊试液中,溶液将先变红后褪色
D.在由水电离出来的c(OH-)=1×10-13的溶液中:NH+4、Ca2+、Cl-、K+一定共存
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com