
5.水是极弱的电解质,在常温下,平均每n个水分子中只有一个水分子发生电离,则n值约为 ( )
A.55.6×107 B.55.6×10-7
C.55.6 D.10-17
4.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发响声,同时产生白色烟雾。撞击时发生的化学方程式为:5KClO3+6P === 3P2O5+5KCl,则下列有关叙述错误的是 ( )
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸的小液滴(雾)
C.上述反应中消耗3mol P时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
3.下列离子方程式书写正确的是 ( )
A.NaHCO3溶液中加入过量的Ba(OH)2溶液
2HCO-3+Ba2++2OH- ==== BaCO3↓+2H2O+CO2-3
B.过量的SO2通入NaOH溶液中:SO2+OH- === HSO-3
C.NaNO2溶液中加入酸性KMnO4溶液
MnO-4+5NO-2+6H+ ==== Mn2++5NO-3 + 3H2O
D.CaCO3溶解于稀硝酸中:CO2-3+2H+ ==== CO2↑+H2O
2.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是 ( )
A.标准状况下,33.6LH2O含有9.03×1023个H2O分子
B.2.24LCO2中含有原子数为0.3×6.02×1023
C.4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023
D.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
1.2007年4月22日是第38个“世界地球日”,本年的宣传主题是:“善待地球--从节约资源做起。”党的十七大也提出要推进“节能减排”工作,促使化工企业可持续发展。下列叙述与“节能减排”不相符的是 ( )
A.提倡使用一次性发泡塑料餐具和塑料袋
B.化工生产中,严格治理三废(废水、废气、废渣),并尽可能把“三废”变废为宝
C.硫酸生产过程中,在沸腾炉旁边设置“废热”锅炉,产生蒸汽来发电
D.推广使用乙醇汽油有助于减轻大气污染,改善大气环境
2.请将第I卷(选择题)的答案用铅笔在机读卡相应位置涂黑。请将第II卷(非选择题)的答案填写在第II卷上,考后仅收机读卡和答题卷。
可能用到的原子量:O 16 Si 28 Cu 64
第Ⅰ卷(选择题 共48分)
选择题(1至8小题为选择题,每小题6分,共48分。在每小题给出的四个选项中,只有一个选项是符合题目要求的。)
23. (8分)将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:CO+H2O(g) CO2+H2,此时有
(8分)将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:CO+H2O(g) CO2+H2,此时有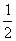 的CO转化为CO2。
的CO转化为CO2。
(1)该平衡混合物中CO2的物质的量分数为 。
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率
(填“增大”、“减小”、“不变”)
(3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达新平衡时CO2的物质的量分数为 。
(4)若在相同条件下,开始时向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的 (填编号)
A.16.67% B.27.55% C.33.3% D.36.8%
22.(13分)为了探究铜与浓硫酸的反应,选用以下装置
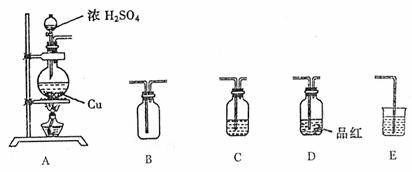
(1)装置A中发生反应的化学方程式 。
(2)若要使B中收集满干燥的SO2气体(应能证实B中已收集满)请写出上述装置的连接顺序: 接 接 接 接 。
(3)C和E装置中所盛装的试剂名称为C E ;E的作用是 。
(4)证明B中已收集满SO2的方法是 .
(5)实验中,取一定质量的铜片和一定体积、浓度的18mol·L-1的浓硫酸共热,至反应停止,发现反应器中仍有铜片剩余,此时溶液中是否还会有一定量的酸剩余,
(填“有”或“没有”),说明分析理由
。
21.知周期元素的单质X、Y、Z在通常状况下均为气态,并存在下列转化关系(反应条件略去):
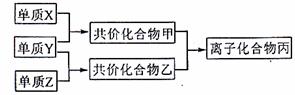
已知:在常见双原子单质分子中,X分子含共价键最多;甲分子含10个电子,乙分子含18个电子。 回答下列问题:
(1)X的电子式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
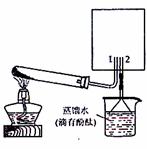
①从下列装置中选出上图方框内收集甲的装置是 。
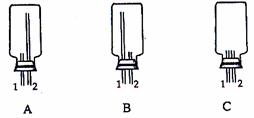
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
(3)磷在单质Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外电子层均满足8电子结构,丁的化学式是 。
20.(9分)A、B、C、D、E为五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的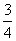 倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
(1)写出下列元素的元素符号:B ;D 。
(2)C与E形成化合物时化学键的类型是 。
(3)D与C的氧化物水化物在溶液中反应的离子方程式为
(4)用A元素的单质和B元素的单质制成的新型化学电源已在宇宙飞船中使用。如下图所示,两个电极均由多孔性材料制成,气体由空隙中通入,并在电极表面放电。①a是 极。②b极的电极反应式为: 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com