
3.下列不符合当今化学研究方向的是: ( )
A.发现新物质 B.合成新材料
C.研究化学反应的微观过程 D.研究化学反应中原子守恒关系
2.2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期为:
( )
A.铼 第六周期 B.镭 第七周期
C.钅仑 第七周期 D.氡 第六周期
1.2007年10月24日,嫦娥一号正式升空,标志着我国探月活动又迈出了实质性的一步。嫦娥一号两侧各装有一个大型展开式太阳电池翼,当两侧太阳翼完全展开后,最大跨度可达18米。该太阳能电池翼板所用硅晶是单晶硅,其能量转化率比多晶硅高8%。对于有关硅元素的叙述正确的是: ( )
A.硅的晶体属于原子晶体 B.自然界中含有少量的单硅晶
C.硅的氢化物比氨气稳定 D.光导纤维的主要原料是多晶硅
12.(15分)工业上黄铁矿原料制H2SO4,请回答下列问题:
(1)燃烧黄铁矿是在 (填设备名称)中进行的。
(2)在接触室中生成SO3反应条件的选择,可以完全用勒夏特列原理解释的是(填标号) 。
A.温度为400℃-500℃ B.常压 C.O2过量 D.用V2O5作催化剂
(3)硫酸工业的尾气中,除含有N2、O2外,还含有SO2、微量SO3和酸雾,为保护环境和提高综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。处理方法可采用过量氨水吸收,主反应的化学方程式为 ,同时还能发生多个反应,写出其中可能发生的两个氧化还原反应的反应式(或离子方程式): 。
(4)SO2尾气心理学 可用饱和Na2SO3溶液吸收而得重要化工原料,反应的离子方程式为 。
(5)黄铁矿的煅烧产物Fe2O3(或Fe3O4等)溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
11.(14分)如下图所示装置中:a是盛有标准状况下的空气(氧气占1/5)和10mL 1.2mol/L硝酸的250mL烧瓶;b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球;c是夹紧了弹簧夹;d中盛有足量的过氧化钠;e是充有二氧化碳的针铜。整套装置已经过气密性检查合格。

(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有剩余(设产生的气体不溶解于溶液中),则可观察到的现象是 。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施。若用加入化学试剂法,下列试剂中可以选用的是 。
A.蒸馏水 B.无水醋酸钠 C.铜粉 D.少量硝酸银溶液
(3)将烧瓶不断振荡发现气球逐渐缩小,反应的化学方程式是 ,此时气球是全部在烧瓶外还是一部分进入烧瓶? 。
(4)打开弹簧夹c,将二氧化碳推入干燥管内,继续振荡烧瓶,使气体与气体、溶液充分接触,欲使所有的铜粉全溶解,至少需要推入二氧化碳 mL。
(5)将上述过程用一个总的化学方程式表示 。
10.(16分)t℃时,将2mol N2和1mol H2通入体积为2L的恒温容密闭容器中,发生如下反应:N2(g) + 3H2(g) 2NH3(g);△H<0.2min后反应达到平衡,此时测得NH3的物质的量为0.2mol。请填写下列空白:
 (1)从反应开始至达到化学平衡,生成NH3的平均反应速率为
;平衡时N2转化率为
。
(1)从反应开始至达到化学平衡,生成NH3的平均反应速率为
;平衡时N2转化率为
。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同) 。
A.容器内压强不再发生变化
B.H2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2的同时消耗3n mol H2
E.相同时间内消耗n mol N2的同时消耗2n mol NH3
F.容器内气体的密度不再发生变化
(3)反应达平衡后,以下操作将引起平衡向正反应方向移动,并能提高N2转化率的是:
A.向容器中通入少量N2 B.向容器中通入少量H2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和N2、H2、NH3都不发生反应)
(4)维持上述恒温恒容条件步变,若起始加入a mol N2、b mol H2、c mol NH3,反应向逆方向进行,平衡时NH3的物质的量仍然为0.2mol,则c的取值范围是 。
(5)保持温度不变,使体积缩小为原来的一半,则N2的体积分数 (填“增大”“减小”或“不变”)。请通过计算证明你的结论。
9.(15分)短周期元素的常见单质A、B、C、D在通常状况下均为气态,其中B分子中共价键最多,单质A分别与B、C、D在一定条件下发生反应,得到相应的共价化合物E、F、G,通常状况下F为液体,E、G为气体,且E与G可反应得到离子化合物H,H中的阳离子含有10个电子,阴离子含有18个电子。
(1)H的电子式是 。
(2)C和E在催化剂作用下反应的化学方程式为 1mol还原剂完全反应失去的电子为 mol。
(3)实验室可用下图所示装置制备E(仅给出发生装置)

①试管中的固体试剂是(填写化学式) 。
②收集气体E,可用的方法是 ,若用大试管收集E,则注意事项有 。
③若实验室中,为防止气体E污染环境而要求设计一个吸收E的装置,(仪器试剂斟酌取用)请画出吸收装置图(不考虑与其他实验装置连接) 。
8.尼泊金醋是国际上公认的广谱性高效食品防腐剂,下图是一种尼泊金酯的球棍模型。下列有关说法正确的是 ( )
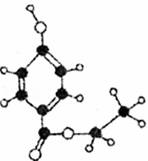
A.尼泊金酯可溶于水 B.尼泊金酯不能发生取代反应
C.尼泊金酯的分子式为C9H12O3 D.1mol尼泊金酯最多可与2molNaOH反应
|
7.下列关于盐酸与醋酸两种溶液的说法正确的是 ( )
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol·L-1的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释的100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
6.2007年10月10日,瑞典皇家科学院在斯德哥尔摩宣布,将2007年诺贝尔化学奖授予在表面化学研究领域作出开拓性贡献的德国科学家格哈德·埃特尔。埃特尔的研究有助于人们理解“铁为什么会生锈”、“燃料电池和汽车中的催化剂如何工作”、“南极上空的臭氧层如何被破坏”等问题。半导体工业也是与表面化学相关联的领域。下面说法正确的是 ( )
A.火星大气的主要成分是二氧化碳,只有少量的氧气、水蒸汽,所以在火星上,铁钉不会生锈
B.氢氧燃料电池以铂作电极,KOH溶液作电解质溶液。该电池的负极反应为:
O2+2H2O+4e- === 4OH-
C.空气中臭氧的体积分数超过10-6%时,就会对人体健康造成危害
D.近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体材料的新粮食”,这是利用了镓的导电性介于导体和绝缘体之间的性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com