
1.下列叙述正确的是 ( )
A.绿色食品是不含任何化学物质的食品
B.推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应
C.在含硫的燃料中加入适量生石灰,可以减少二氧化硫的排放量
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
33.(8分)[化学--有机化学基础]
(1)莽草酸是合成治疗禽流感的药物达菲的原料之一。莽草酸是A的一种异构体。A的结构简式如下图:
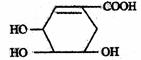
①写出A的两种官能团的名称________ ____。
②写出A与溴的四氯化碳溶液反应的化学方程式___________ ____。
(2)双酚F的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱、导致生育及繁殖能力异常的环境激素,其结构简式为:
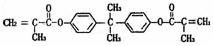
它在一定条件下可以水解生成双酚F和羧酸A。双酚F可按以下途径合成:
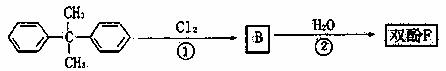
反应②的反应类型是___________ ____化合物 的一氯代物有___________种。
的一氯代物有___________种。
(3)有机物A为茉莉香型香料,由A合成C的反应如图,A的分子组成为C14H18O,C的组成为C14H18O2Br2。

①若(2)所用的试剂是盐酸,则(1)应该选用的试剂名称是 (供选择的试剂:银氨溶液、酸性高锰酸钾溶液、盐酸、溴水)。
②烃基-R1不含支链且与-OH形成的有机物R1-OH能与浓溴水反应生成白色沉淀,有机物A中只有一个甲基,A 的结构简式为___________ ____。
32.(8分)[化学--物质结构与性质]
A、B、C、D分别代表四种不同的短周期元素。A元素的最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子是其电子层的数的3倍,D元素原子的M电子层的p亚层中有3个电子。
(1)C原子的电子排布式为_______,若A元素的原子最外层电子排布为S′,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于__________键。
(2)当n=2时,B的原子结构示意图为________,B与C形成的晶体是_______晶体。 当n=3时,B与C形成的晶体中微粒间的作用力是_______________。
(3)若A元素的原子最外层电子排布为3S′,B元素的原子价电子排布为3S23P2,元素A在周期表中的位置是__________,A、B、C、D四种元素的第一电离能由大到小的顺序是 __________(用元素符号表示)。
31.(8分)[化学--化学与技术]
亚硝酸钙[Ca(NO2)2]为白色固体,易溶于水,常用于作混凝土的缓蚀剂、具有防锈、防冻、速凝等作用。工业上常用石灰乳吸收NOx气体的边续吸收法生产亚硝酸钙,工艺流程如图所示:
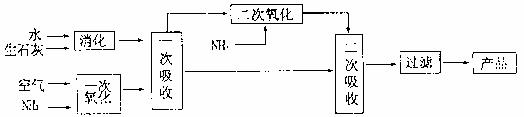
(1)一次氧化可以得到NO和NO2的混合气体,相关的化学方程式为 。
氨的氧化反应在化学工业中还有多种实际用途,其中的一个用途是 。
(2)经一次吸收后,可得到亚硝酸钙的化学方程式为 。
(3)采用二次吸收的目的是 。
(4)二次吸收后的尾气若直接向大气中排放,造成的后果是 。
(5)过滤后,要得到的固体产品,在实验室可进行的操作是 。
30.(20分)(1)某学校活动小组运用下列的装置仪器进行探究SO2与O2反应的产物,并测定此条件下SO2的转化率。已知SO3的熔点为16.8℃,沸点为44.8℃。
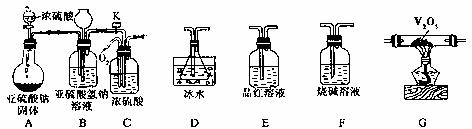
①要完成上述实验目的,仪器的连接顺序为A→B→C→ → →
→ (填序号)。
②装置C有三个作用。除使SO2和O2混合外,还有 、 。
③实验时,装置D的锥形瓶中盛放足量的溶液,该溶液可以是 (填序号),发生反应的离子方程式是 。
a.足量的硝酸钡溶液 b.足量的小苏打溶液
c.足量高锰酸钾溶液 d.足量氯化钡溶液
④反应停止后,先关闭K,继续通入O2的目的是 。
⑤若已知锥形瓶中溶液沉淀的质量为m g,装置A中放入的亚硫酸氢钠的质量为n g,测得E装置中增加的质量为e g,装置F中增加的质量为f g。 则SO2转化率的表达式为 。
(2)某化学实验探究兴趣学习小组在“探究卤素单质氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液的颜色呈黄色。
提出问题:Fe3+和Br2谁氧化性更强
猜想:
①甲同学认为氧化性:Fe3+强于Br2,则溶液呈现黄色是含 (填化学式)所致。
②乙同学认为氧化性:Fe3+弱于Br2,则溶液呈现黄色是含 (填化学式)所致。
设计实验并验证:
丙同学为验证甲同学的观点,选用下列某些试剂设计出方案并进行实验,并且通过实验证明了甲同学的观点确实是不正确的。
供选择的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.KSCN溶液
③用于证明甲不正确所选用的试剂是 (填序号),实验操作及实验现象是
。
④向含有0.1mol FeBr2的溶液通入2.24L Cl2(STP)的反应的离子方程式为 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(11分)原电池和电解池原理在工农业生产、科技和我们的日常生活中有着重要的应用。
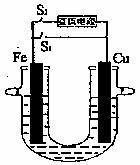
如图装置中,若断开S2接通S1:
(1)当电解质溶液为500mL 2.00mol·L-1CuSO4溶液中,反应一段时间后,铜电极的质量变化了4.48g,则Cu电极的电极反应式为 ,Fe电极的电极名称是 极,电解质溶液的质量变化是 。
如图装置中,若断开S1接通S2:
(2)①目前世界上比较先进的电解制碱技术是离子交换膜法。电解法制碱的主要原料是饱和食盐水,由于粗盐中含有的泥沙、Ca2+、Mg2+、Fe3+、SO 杂质,不符合电解要求,必须经过精制。除去SO
杂质,不符合电解要求,必须经过精制。除去SO 可用的钡试剂是 (填序号)。
可用的钡试剂是 (填序号)。
A.Ba(NO3)2 B.Ba(OH)2 C.BaCl2
②当如图的装置中的电解质溶液为氯化钠溶液时,若铜电极与直流电源的负极相连,铜电极上的现象是 ;该电解过程发生反应的离子方程式为 。
(3)要在Fe上镀上一层铜,Fe电极应与直流电源的 极相连,可选 溶液做电解质溶液。
28. (11分)(1)对于反应aA(g)+bB(g)
pC(g)在不同的反应条件下测得以下数据(表中为C的体积百分数)。
(11分)(1)对于反应aA(g)+bB(g)
pC(g)在不同的反应条件下测得以下数据(表中为C的体积百分数)。
 压强/MPa
压强/MPaC% 温度/℃ |
0.1 |
10 |
20 |
30 |
60 |
100 |
|
200 |
15.3 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
|
300 |
2.2 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
|
400 |
0.4 |
25.1 |
38.2 |
47.0 |
X |
79.8 |
|
500 |
0.1 |
10.6 |
19.1 |
26.4 |
42.2 |
57.7 |
通过表中数据分析可得出:该化学反应的△H 0(填:“<”或“=”或“>”);
a、b、p三者的大小关系是a+b p(填:“<”或“=”或“>”);表格中X的数值可能为 (填序号)。
A.39.0 B.45.2 C.65.2 D.82.8
(2)若开始时按n(A): n (B)=a:b=3:1进行反应,达平衡时C的体积分数a:b:p= 。
 (3)某温度下,在5L的密闭容器中,反应3A2(g)+B2(g) 2C(g)的n(A2)、n(C)随时间(t)的变化情况如图所示:反应达t0时,用B2表示的平均反应速率为v(B2)= ;e和d两点平衡常数K的关系是Ke= Kd(填:“<”或“=”或“>”);若达到平衡时,K=25/27L2·mol-2时,B2的转化率为
。
(3)某温度下,在5L的密闭容器中,反应3A2(g)+B2(g) 2C(g)的n(A2)、n(C)随时间(t)的变化情况如图所示:反应达t0时,用B2表示的平均反应速率为v(B2)= ;e和d两点平衡常数K的关系是Ke= Kd(填:“<”或“=”或“>”);若达到平衡时,K=25/27L2·mol-2时,B2的转化率为
。

14.下列说法中,正确的是 ( )
A.相同物质的量浓度、相同体积的强酸与强碱溶液混合反应后所得溶液pH=7
B.pH=5的盐酸与pH=5硝酸铜溶液中,水电离的程度相同
C.AlCl3溶液与过量的氨水混合反应的离子方程式为:
Al3++4NH3·H2O=[Al(OH)4]-+4NH
D.pH>7的HCN与NaCN的混合溶液中离子浓度的大小关系为:
[Na+]>[CN-]>[OH-]>[H+]
|
 A.由反应N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ·mol可知:1molN2与3mol H2发生反应,在298K 101kPa条件下放出的热量等于92.2kJ
A.由反应N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ·mol可知:1molN2与3mol H2发生反应,在298K 101kPa条件下放出的热量等于92.2kJ
B.由C(石墨,s)=C(金刚石,s)△H =+1.9kJ·mol可知,金刚石比石墨稳定
C.在稀溶液中H+(aq)+OH-(aq)=H2O(l) △H =-57.3kJ·mol,由此可知含0.05molH2SO4的浓硫酸与100mL 1.0mol·L-1NaOH溶液反应放出的热量等于5.73kJ
D.同条件下,等质量的硫蒸气和硫固体分别完全燃烧生成二氧化硫气体,前者放出的热量多
|
13.下列各推断中,正确的是 ( )
A.某气体通入品红溶液中,品红溶液褪色,则该气体一定是二氧化硫气体
B.向某盐溶液中加入足量的稀盐酸,产生的气体能使澄清的石灰水先变浑浊再变澄清,则该盐溶液一定是碳酸盐溶液
C.由于Ksp(AgCl)>Ksp(AgBr),那么AgCl溶液能够与KBr-发生反应
D.向某溶液中加入KSCN溶液,没有出现血红色,该溶液中不可能含铁元素
12.下列关于氧化还原反应的叙述中,错误的是 ( )
A.从海水中提取溴,主要反应为2Br-+Cl2=Br2+2Cl-,该反应中Cl2发生还原反应
B.实验室常常悬挂CuI试纸来监测空气中汞蒸气的含量并发生4CuI+Hg=Cu2HgI4+2Cu反应,当参加反应的CuI的物质的量为2mol时,有2mol电子发生转移
C.向含有Mg2+、Cu2+、Ag+离子的硝酸盐溶液中加入适量的锌粉,首先置换出来的金属是Ag
D.由于浓度的不同,硫酸在锌与硫酸溶液反应中表现出的氧化性强弱不同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com