
5.下列现象中,不能用胶体知识解释的是
A.向豆浆中加入盐卤可制作豆腐
B.清晨在密林中看到一缕缕光束
C.向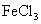 溶液中加入
溶液中加入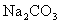 溶液,会出现红褐色沉淀
溶液,会出现红褐色沉淀
D.在河水与海水的交汇处,有沙洲形成
4.下列对物质用途的描述中,错误的是
A.镁铝合金密度较小、强度高,常用作制造航天器的材料
B. 、
、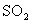 、
、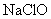 均可用于漂白
均可用于漂白
C.浓硫酸具有吸水性,可用于干燥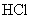 、
、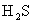 、
、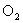
D.可通过铝热反应冶炼某些熔点较高的金属
3.已知“凡气体分子总数增多的反应一定是熵增大的反应”。根据所学知识判断,下列反应中,在所有温度下都不自发进行的是
A.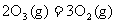 △H<0
△H<0
B.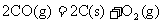 △H>0
△H>0
C.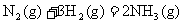 △H<0
△H<0
D.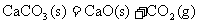 △H>0
△H>0
2.“嫦娥奔月”是一个充满浪漫主义的中国神话故事。2007年10月24日我国“嫦娥一号”探月卫星由长三甲火箭送入预定的轨道。长三甲火箭第三级推进剂采用低温液氧/液氢。已知在298 K时,2 g氢气与氧气完全反应生成液态水放热285.8 kJ,则此反应的热化学方程式为下列的
A.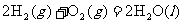
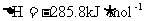
B.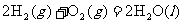
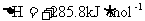
C.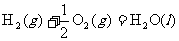
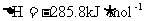
D.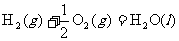
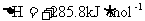
1.2008年将在我国北京举行夏季奥运会,这次奥运会提出要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指
A.把环境保护作为奥运设施规划和建设的首要条件
B.运动员的食品全部是未加任何添加剂的食品
C.奥运场馆建设均使用天然材料建造,不使用人工合成材料
D.所有奥运用品全部是绿色的
|
反应过程 原料 |
原料生产工艺过程 |
|
乙炔 |
CaCO3 CaO CaO CaC2 CaC2 C2H2 C2H2 |
|
乙烯 |
来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛:________________________________
b.乙烯氧化法制乙醛:________________________________
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因:
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?________________
(4)若将上述两种方法的反应条件,均增加“100atm”,原料平衡转化率(填增大、减小、不变);而实际生产中不采用的理由是__________________________________________
____________________
(5)若乙烯由石油裂化气(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气各多少mol?(用m、n代数式表示)
27.(20分)将甲、乙两铂片插入200g10%的CuSO4溶液中进行电解,当阳极析出0.16g气体时,求:
(1)阴极析出多少克铜?CuSO4溶液的质量分数是多少?
(2)需要多少电量?
(3)若在12V的电压下需要多少电能?
(4)在压强为latm,温度为27℃时,氧气的体积为多少?(标准状态为PO=latm,T=273K)
|
物质 物质 |
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2、CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
21.(12分)下列是元素周期表的一部分,表中所列的字母分别代表一种化学元素,试回答下列问题
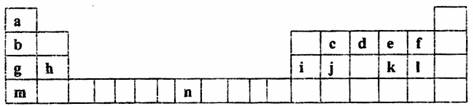
(1)请写出元素n的基态原子电子排布式 。
(2)第二周期某元素能与元素a形成由4个原子构成的10个电子分子。该分子的中心原子杂化方式为 ,分子的空间构型为 。
(3)第三周期7种主族元素按单质熔点高低的顺序如下左图所示,其中序号“7)代表
(填元素符号);其中电负性最大的是 (填下左图中的序号)。
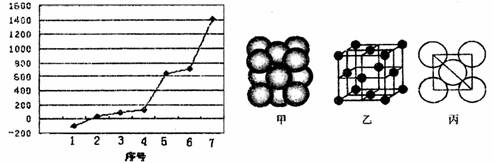
(4)i单质晶体中原子的堆积方式如上右图甲所示,其晶胞特征如上右图乙所示,原子之间相互位置关系的平面图如上右图丙所示。则:晶胞中i原子的配位数为
,一个晶胞中i原子的数目为 。
20.(9分)将K2SO4、(NH4)2SO4、NH4HCO3的固体混合物若干克加入到100mL 0.5mol/L的Ba(OH)2溶液中,共热使之充分反应,NH3全部逸出,同时生成沉淀8.6g。在所得固液混合物中加100mL 0.9mo/L的盐酸,沉淀部分溶解,同时生成448mL CO2气体(标准状况)。剩余盐酸用50mL 0.2mo/L的NaOH溶液恰好中和。求原混合物中各物质的质量。
19.(12分)现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1,M2,M3,并依次增加14。经分析,相对分子质量为M2的酯,其氧元素所占的质量分数为31.4%,并有三种酯的同分异构体。请回答:
(1)相对分子质量为M2的酯的化学式为 。
(2)参加反应的饱和一元羧酸的化学式分别为 , 。
(3)参加反应的醇结构简式为 、 、 、
(不必填满)。
(4)与相对分子质量为M1的酯互为同分异构体,能发生银镜反应、能与金属钠反应产生氢气的有机物的同分异构体有 种。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com