
6. 2007年6月20日,新浪网报道了中国矿业大学发生的铊中毒事件。铊(TI)在元素周期表中与铝处于同一主族,与铯(Cs)处于同一周期。下列有关说法正确的是( )
A.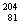 TI与
TI与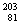 TI互为同素异形体 B.
TI互为同素异形体 B.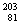 TI与
TI与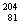 Pb具有相同的中子数
Pb具有相同的中子数
C.TI81核外有6个电子层 D.TI原子半径大于Cs原子半径
24.(8分)[化学--物质结构与性质]
今有位于元素周期表短周期中的X、Y、Z三种元素。已知:
①三者原子序数之和为25;
②元素Y的原子价电子排布为 ;
;
③X和Y在不同条件下可形成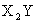 和
和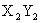 两种固态化合物,Y和Z在不同条件下可形成ZY和
两种固态化合物,Y和Z在不同条件下可形成ZY和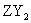 两种气态化合物;
两种气态化合物;
④元素Z的硫化物与元素Z的氯化物,常温下均为液态,且二者的相对分子质量之比为38∶77。
据此填写下列空白:
(1)写出元素符号:X. ;Y. ;Z. 。
(2)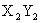 属于
晶体,构成晶体的微粒是
(填微粒符号)。
属于
晶体,构成晶体的微粒是
(填微粒符号)。
(3)Z的硫化物的分子空间构型是
,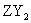 形成的晶体属于 晶体,根据原子轨道重叠方式的不同,Z的氯化物分子中含有的共价键种类及数目是
。
形成的晶体属于 晶体,根据原子轨道重叠方式的不同,Z的氯化物分子中含有的共价键种类及数目是
。
23.(8分)[化学--有机化学基础]
下列框图表示A、B、C、D、E、F、G、H、I各物质间的转化关系,已知有机物H分子中含有5个碳原子。有机物I是一种高分子材料。
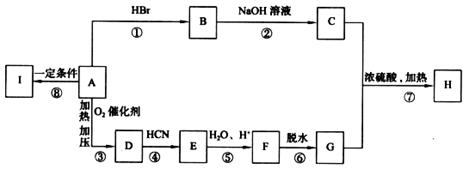
请回答下列问题:
(1)物质D和I的结构简式为:D. 、I. 。
(2)指出反应类型:反应④属 ;⑥属 。
(3)写出下列反应的化学方程式:
反应②
反应⑦
(4)写出与H具有相同官能团且只含有一个甲基的同分异构体的结构简式(除H外,请写出任意两种) , 。
22.(12分)汞单质及其化合物在工业生产和科学研究上有广泛的用途,汞唯一重要的矿源是朱砂(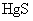 )。朱砂炼汞的反应之一为:
)。朱砂炼汞的反应之一为: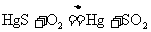 。
。
请回答下列问题:
(1)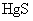 与
与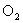 的反应中,氧化剂是 ,每生成1 mol Hg转移电子的物质的量为 mol。
的反应中,氧化剂是 ,每生成1 mol Hg转移电子的物质的量为 mol。
(2)电解某汞的硝酸盐溶液,当阴极消耗a mol金属阳离子时,可获得2a mol金属单质,同时阳极可得0.5a mol的气体产物。则该气体产物是 (填化学式),由此可推断得知该盐的化学式是 。其阳极上的电极反应式是 。
(3)随着冶炼、电镀等工业生产的不断发展,所需汞及其化合物的用量也日趋增多,随之排放出来的含汞的废水也愈加严重,现已成为世界上危害较大的工业废水之一。以下处理含汞(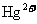 )废水的方法中最简单实用的是
(填序号)。
)废水的方法中最简单实用的是
(填序号)。
A.向含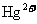 的废水中加入
的废水中加入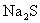 等可溶性硫化物
等可溶性硫化物
B.加入金属还原剂
C.电解法
[选做部分]
21.(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
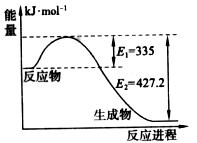
(1)下图是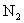 和
和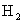 反应生成2 mol
反应生成2 mol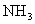 过程中能量变化示意图,请计算每生成1mol
过程中能量变化示意图,请计算每生成1mol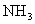 放出热量为
。
放出热量为
。
(2)在一定体积的密闭容器中,进行如下化学反应: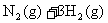

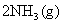 ,其化学平衡常数K与温度t的关系如下表:
,其化学平衡常数K与温度t的关系如下表:
|
T/K |
298 |
398 |
498 |
… |
K/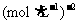 |
4.1×106 |
K1 |
K2 |
… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”),
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内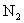 、
、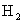 、
、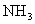 的浓度之比为1∶3∶2
的浓度之比为1∶3∶2
B.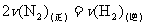
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(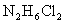 )是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与
)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与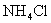 类似。
类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.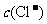 >>
>>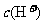 >
>
B.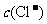 >
>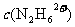 >
> >
>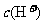
C.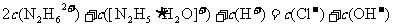
D.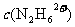 >
>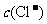 >
>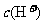 >
>
20.(9分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
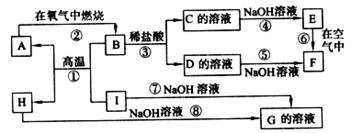
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在元素周期表中位置 。
(2)写出C、H物质的化学式:C. ,H. 。
(3)写出反应①、⑦的化学方程式:
反应①:
反应⑦:
(4)反应⑥过程中的现象是 。
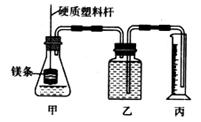
19.(12分)某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如下图所示的简易实验装置。该实验的主要操作步骤如下:
①配制浓度均为1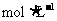 的盐酸和醋酸溶液;
的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL1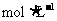 的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为ag的镁带(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁带浸入酸中至反应完全。
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法: 。
(2)量取10.00 mL1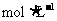 盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是
(填下列各项序号字母)。
盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是
(填下列各项序号字母)。
A.50 mL量筒 B.10 mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁带质量不能少于 g。
(4)步骤⑤中需记录的数据是 ;实验过程中观察到的主要现象是 。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为 (填“偏大”、“偏小”或“无法确定”)
(6)为保证实验顺利进行,仪器丙应选用的规格是 (填序号字母)。
A.100 mL B.200 mL C.500 mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为
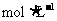 。
。
18.(8分)(1)安全教育是化学教育的重要内容。根据你掌握的知识判断,下列各项中,符台安全操作要求的是 (填写序号)。
①在加油站内拨打手机
②在煤矿巷道内用明火照明
③闻氯气的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔
④为了节约药品,锌与稀硫酸一开始反应,就做氢气点燃实验
⑤稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌
(2)下图为常见仪器的部分结构(有的仪器被放大)
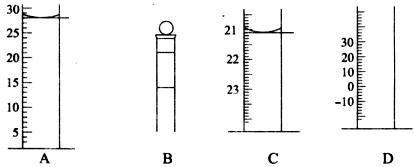
A图中液面所示溶液的体积为 mL,C图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是 (填仪器序号字母)。
(3)粗盐经提纯后得到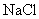 溶液,再经蒸发、结晶、烘干得精盐。
溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的瓷质仪器的名称为 。
②该同学将所得精盐配成溶液,用于另一实验。实验中需要用100 mL1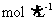 的
的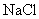 溶液,配制过程中需用托盘天平称取的精盐质量为
g,用于定容的玻璃仪器的规格和名称
。
溶液,配制过程中需用托盘天平称取的精盐质量为
g,用于定容的玻璃仪器的规格和名称
。
17.将1 mol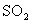 和1 mol
和1 mol 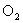 通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:
通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应: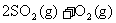

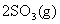 。反应达到平衡时
。反应达到平衡时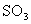 为0.3 mol。若此时移走0.5 mol
为0.3 mol。若此时移走0.5 mol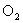 和0.5 mol
和0.5 mol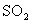 ,则重新达到平衡后,
,则重新达到平衡后,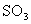 的物质的量为下列的
的物质的量为下列的
A.等于0.3 mol B.等于0.15 mol
C.小于0.15 mol D.大于0.15 mol,小于0.3 mol
第Ⅱ卷(必做和选做 共59分)
[必做部分]
16.有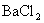 和
和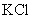 的混合溶液V L,将它均分成两份。一份滴加稀硫酸,使
的混合溶液V L,将它均分成两份。一份滴加稀硫酸,使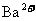 离子完全沉淀;另一份滴加
离子完全沉淀;另一份滴加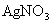 溶液,使
溶液,使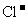 离子完全沉淀。反应中消耗m mol
离子完全沉淀。反应中消耗m mol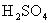 、n mo
、n mo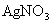 。据此得知原混合溶液中的
。据此得知原混合溶液中的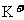 的物质的量浓度为
的物质的量浓度为
A.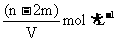 B.
B.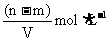
C.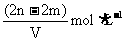 D.
D.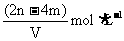
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com