
27.(18分)某研究性“学习小组利用以下装置探究氯气与氨气之间的反应: 其中A、F分别为氨气和氯气的发生装置,C为氯气与氨气反应的装置。
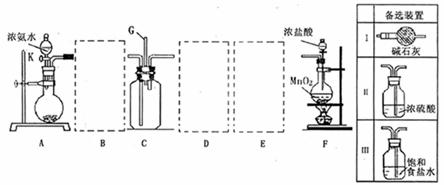
请回答下列问题:
(1)如何检查装置A的气密性:
。
(2)装置F中发生反应的离子方程式: 。
(3)装置A烧瓶内的固体可以选用 (填序号)。
a.碱石灰 b.生石灰 c.二氧化硅 d.五氧化二磷 e.烧碱
(4)虚线框B、D、E内应连接必要的气体净化装置,请从上图的“备选装置”中选择必要的装置,将其编号填人空格中:
B 、D 、E 。
(5)氯气和氨气反应可能生成氯化铵,实验中观察到装置C内出现浓厚的白烟,并在容器壁上凝结成白色固体,请设计实验方案确定该固体是氯化铵,填写下列空白(可以不填满):
①操作: ;现象和结论: 。
②操作: ;现象和结论: 。
③操作: ;现象和结论: 。
(6)该装置还有不足之处,请你帮助他们改进: 。
26.(16分)U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次增大。已知:①WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;②Z的单质在X2中燃烧的产物可使品红溶液褪色;③V的单质在X2中燃烧可生成VX和VX2两种气体;Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)W的单质分子的结构式为 ;Y2X2的电子式为 ;
Z元素在周期表中的位置是 。
(2)写出Y2X2与水反应的化学方程式: 。
(3)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
(4)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为
。
(5)由U、V、W、X四种元素组成的离子化合物A,其原子个数比为7:2:1:2,则A为 (写名称),A的水溶液的pH约等于7,其原因是 。
13.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中粒子浓度间的关系正确的是 ( )
A.c(NO )>c(OH-)>c(NH
)>c(OH-)>c(NH )>c(Ba2+)
)>c(Ba2+)
B.c(NO )> c(Ba2+)>c(NH
)> c(Ba2+)>c(NH )>c(OH-)
)>c(OH-)
C.c(NO )= c(NH
)= c(NH )+c(NH3·H2O)+c(NH3)
)+c(NH3·H2O)+c(NH3)
D.2c(Ba2+)+c(H+)= c(NO )+ c(OH-)
)+ c(OH-)
|
12. 一定条件下,体积为10L的密闭容器,装入1molX和4molY进行如下反应:X(g)+3Y(g) 2Z(g);△H<0经过60s达到平衡,生成0.3molZ。下列说法正确的是( )
一定条件下,体积为10L的密闭容器,装入1molX和4molY进行如下反应:X(g)+3Y(g) 2Z(g);△H<0经过60s达到平衡,生成0.3molZ。下列说法正确的是( )
A.升高温度或减小压强有利于反应向正方向进行
B.60s内X的平均反应速率为0.00025mol/(L·s)
C.达平衡时物质X与Y的转化率相等
D.其他条件不变,将容器体积扩大为20L,Z的平衡浓度变为原来的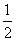
11.下列方程式书写正确的是 ( )
A.次氯酸的电离方程式:HClO=H++ClO-
B.铝溶于烧碱溶液的离子方程式:Al+2OH-=AlO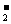 +H2↑
+H2↑
C.电解精炼铜的阴极反应式:Cu-2e-=Cu2+
D.稀硝酸与过量铁屑反应的离子方程式:3Fe+8H++2NO =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
9.下列做法正确的是 ( )
A.做氢气还原氧化铜的实验,先加热氧化铜再通氢气
B.做分解氯酸钾制取氧气的实验后,把剩余的残渣倒入垃圾桶
C.不慎将少量浓硫酸沾到皮肤上,立刻用在量水冲洗
D.配制浓硫酸与酒精的混合液时,把酒精加入盛有浓硫酸的烧杯中
|
A.相同条件下,N2和O2的混合气体与等体积的N2所含的子数相等
B.18gD2O中含有的质子的物质的量为10mol
C.常温常压下30gNO与22.4LCO所含分子数相等
D.标准状况下,33.6L H2O含有9.03×1023个H2O分子
8.下列各组溶液,不用其它试剂就可以将它们区别开的是 ( )
A.盐酸、氯化钾、硫酸钾、碳酸钾
B.氢氧化钾、碳酸钾、硫酸镁、硫酸氢钾
C.氯化钡、硝酸钡、硫酸钠、硝酸钾
D.硝酸钠、盐酸、氯化铵、氢氧化钾
7.某元素的阳离子Rn+1,核外共有x个电子,R原子的质量数为A,则该原子核里的中子数为 ( )
A.A+x+n B.A-x+n C.A+x-n D.A-x-n
选择题一(本题包括18小题。每小题6分,共108分。每小题只有一个选项符合题意。)
6.我国已经决定未来15年大力发展太阳能、风能等新能源。从而减少化合能源的使用。此决策的实施有助于控制 ( )
①温室效应 ②二氧化硫排放 ③白色污染 ④臭氧空洞
A.①② B.①②③ C.①②④ D.①②③④
29.(15分)已知芳香族化合物C的分子式为C9H9Ocl。C分子中有一个甲基且不在苯环上;一定条件下C能发生银镜反应;C与其它物质之间的转化关系如下图所示:

回答下列问题:
(1)C→F的反应类型为 。
(2)高分子H的结构简式为 。
(3)B→A反应的化学方程式为 。
(4)D→E反应的化学方程式为 。
(5)D的一种同系物W(分子式为C8H8O2)的同分异构体很多,试写出符合以下条件的W的三种同分异构体的结构简式:
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应 、 、
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com