
26.(16分)将3.2g Cu与足量的浓硫酸在加热条件下充分反应。
(1)此反应的化学方程式为 ,其中被还原的硫酸的物质的量为 。
(2)把反应后的溶液稀释至500mL,取出50
mL,向其中加入足量的BaCl2溶液,得到沉淀 23.3g,则稀释后所得溶液中SO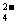 的物质的量浓度为
。
的物质的量浓度为
。
(3) 若浓硫酸中含溶质b mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n(H2SO4) 0.5b mol(填“>”、“<”或“=”=
(4)工业用接触法制硫酸,请回答下列问题:
① 在接触室中生成SO3反应条件的选择,可以完全用勒夏特列原理解释的是______。
A. 用V2O5作催化剂 B. 温度为400℃-500℃ C. 常压 D. O2过
② 在硫酸工业的尾气中,______是主要大气污染物,必须进行净化处理,处理方法可采用过量氨水吸收,反应的离子方程式是__________________________。
13. T °C时气体A与气体B反应生成气体C和固体D。每1 mol A与足量B完全反应时生成1 mol D。反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图②所示。则下列结论正确是
( )
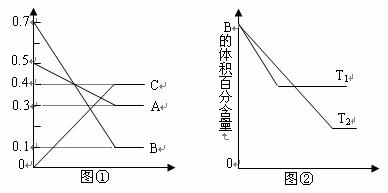 A.该反应的化学方程式是 A+3B = 2C+D
A.该反应的化学方程式是 A+3B = 2C+D
B. 升高温度,其它条件不变时,,正、逆反应速率均增大,且A的转化率增大
C.相同时间内,消耗0.1 mol/L A时,生成了0.3 mol/L B,反应达到平衡
D. T°C若向上述平衡体系中加入0.2 mol C,平衡时A的浓度等于0.4 mol/L
非选择题:共10小题,共174分
12.下列物质存放方法正确的是 ( )
A.药品柜的同一层不可存放浓硝酸和浓氨水
B.少量的钠保存在无水乙醇中
C.少量白磷保存在二硫化碳中
D.硅酸钠溶液保存在玻璃塞的试剂瓶中
11.对下列事实的解释错误的是 ( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐来贮存,说明铝与浓硝酸不反应
D.反应 能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
9.设NA表示阿伏加德罗常数值,下列有关叙述正确的是 ( )
A.在标准状况下,VL水含有的氧原子个数为(V ·NA)/22.4
B.常温常压下,lmol N02气体与水反应生成NA个NO3-
C.lmolO2-含有的电子数为17NA
D.常温常压下,32g
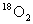 中所含的中子数为20NA
中所含的中子数为20NA
|
A.①②③④ B.①③⑤ C.②③④⑤ D.①②③④⑤
8.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝
③加入氯水时,溶液略显橙色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是 ( )
A.Br- B.SO42- C.H2SO3 D.NH4+
7.下列反应的离子方程式正确的是 ( )
A.向氢氧化钡溶液中加入过量硫酸氢铵溶液:
Ba2+十20H-十NH4+ + H+ + SO42- = BaSO4 ↓+NH3·H2O + H2O
B.氯气和水反应:Cl2+H2O=H++Cl-+HClO
C .在氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
D.铜和稀硝酸反应:3Cu+2H++2NO3-=3Cu2+ +2NO↑+2H2O
6.下列说法中正确的是 ( )
A.臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关
B.由同种元素组成的物质肯定属于纯净物
C.具有相同质子数的微粒都属于同种元素
D.溶液和胶体的本质区别是丁达尔效应
29.(10分)黄铁矿的主要成分是FeS2。某硫酸厂测定黄铁矿中PeS2的含量时,取1.000g 样品在氧气中充分灼烧,将生成的SO2全部通人800mL浓度为0.02000mol/L的确溴水中,恰好使溴水褪色。
(1)样品中FeS2的质量分数是(假设杂质不参加反应) .’
(2)若灼烧6.25g上述黄铁矿产生的S02气体在全部转化为S03气体时放出 9.83kJ热量,写出SO2气体转化为SO3气体的热化学方程式: 。
(3)煅烧20t上述黄铁矿,假设硫元素不损失,完全转化可制得98%的硫酸的质量为 。
28.(16分)下图表示物质A-K在一定条件下的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
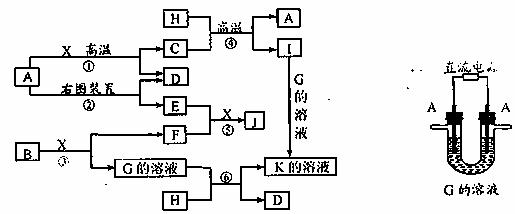
请按要求填空:
(1)写出反应①的方程式: 。
(2)写出生成E的电极反应式: ,
反应⑤的现象是 。
(3)反应④的化学方程式是 。
在实验室中引发反应④的操作是 。
(4)反应⑥的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com